光抑制
在生态学研究中,必须考虑到高光强对光合作用的抑制,因为在阳光明媚的天气中,天然水域表层通常经历的光强处于可以产生光抑制的范围内。实际上,如果在内陆或海洋水域用悬浮瓶法测量浮游植物光合作用活动的深度剖面,则在接近水面的地方通常(尽管并非总是如此)观察到特定光合速率或单位体积速率的显著降低。图l0.4显示了沿海和内陆水域光合作用的表面抑制的例子。随着深度的增加和光强的减小,光抑制作用减弱,达到最大值,光饱和但不抑制光合速率。随着深度的进一步增加,辐照度下降到光强变得有限的点,从这里开始,光合速率大致呈指数级下降,深度与辐照度大致平行。
许多但不是全部的大型植物在光照强度范围内也表现出光合作用的抑制,以phoiflivn Uliesia (rug C m"* h"L> 0 20 40 60 BO 10O 120为例
fldtE of phoiflivn Uliesia(地毯C m"* h"L> 0 20 40 60 BO 10O 120

图10.4浮游植物单位体积水光合速率深度分布图。曲线代表的是内陆水域(英格兰的温德米尔湖;根据Belay, 1981年的数据绘制,假设光合商为1.15),以及沿海水域(Bedford Basin, NS, Canada;根据Marra, 1978年的数据绘制)。
图10.4浮游植物单位体积水光合速率深度分布图。曲线代表的是内陆水域(英格兰的温德米尔湖;根据Belay, 1981年的数据绘制,假设光合商为1.15),以及沿海水域(Bedford Basin, NS, Canada;根据Marra, 1978年的数据绘制)。
从更深的地方采集的藻类尤其如此。517,1162然而,从生态学角度看,这种现象的意义不大,因为任何特定的大型植物物种通常都生长在其所能很好适应的光强的深度(第12章),而浮游植物则是通过水的运动在一定深度范围内循环。然而,一些光抑制有时发生在大型植物中浅水区在中午潮间带的海洋大型藻类间歇性地暴露在非常高的光强度下。在相当于全阳光的辐照度值下,这些物种中的一些不显示抑制,但另一些则部分抑制在亚喀巴湾(红海)的Stylophora pistillata珊瑚中,Winters等人(2003年)使用原位PAM荧光测量,发现生长在2米深处的珊瑚的有效量子产率在正午显著下降(63%),而生长在11米深处的珊瑚仅下降8%。
强光对光合作用的抑制需要时间来形成。以加拿大安大略湖的浮游植物种群为例,光合作用活性在暴露约10分钟后开始下降用悬浮在威尔士湖面上的瓶子中硅藻Asterionella种群对光合作用时间进程的测量表明,光合作用的抑制作用在第一个小时内很小,但在第二个小时内变得显著在一定光强下,温度越高,抑制发生得越快在实验室培养的Asterionella生长在18°C和200 mmolphotonsm-2s-1的情况下,暴露在2000 mmolphotonsm-2s-1充足的阳光下,在18°和25°C下1小时,随后测量的光合速率分别降低了约10%和50%
如果浮游植物被转移到较低光强的环境中,它们就能从强光的抑制作用中恢复过来暴露在强光下的时间越长,恢复的时间就越长。以威尔士湖中的Asterionella种群为例,暴露在强光下2小时后,在低光强度下4小时后才能完全恢复:在强光下6小时后,光合速率降低了70%,恢复需要20小时91
光抑制机制在高等植物中已得到了较为详细的研究。Jones和Kok(1966)测量了光谱菠菜中电子传递的光抑制叶绿体.光谱显示其主要活性在紫外(UV)区域,峰值在250 ~ 260 nm。光抑制也发生在可见区域,但量子效率低得多。在400 ~ 700 nm之间,作用谱紧随其后吸收光谱叶绿体色素的一种,在670 ~ 680 nm处有明显的叶绿素峰。病变似乎主要通过破坏光合作用的光反应光系统的反应中心ii.265,266,230
紫外区作用谱的形状表明,在反应中心起作用的质体醌或其他醌类分子可能是抑制紫外的敏感分子。UVB损伤光合系统的主要部位似乎是光系统II,这表明光系统II的醌类初级电子受体QA是关键靶点。可见区域作用光谱的形状表明,在非常高的光强度下,光合色素本身吸收的一些能量被转移到一个敏感部位——不一定是受紫外线影响的部位——在那里造成损害。
虽然还没有对藻类光合作用的光抑制进行详细的研究,但最合理和最经济的假设是,其机制与高等植物相同。对于海洋浮游植物,观察到的光抑制被发现与使用Jones和Kok作用谱计算的每日生物剂量呈线性变化。1247在清澈海水的表层,50%的光抑制剂量在波长小于390 nm处;在10 m深的中等生产力水域(0.5mgchl am~3), 50%的光抑制剂量位于波长小于430nm .1243的波长因此,对于海水,我们可以将大约50%的光抑制归因于紫外线,大约50%归因于可见光。现场测量由史密斯等人(1992)在别林斯高晋海海1990年南方春季的研究表明,南极边缘的初级生产冰带臭氧损耗引起的紫外线通量增加抑制了6%至12%。Clendennen等人(1996)发现,在巨型海带巨藻(Macrocystis pyrifera)中,使光合作用减少50%的紫外线剂量导致功能性光系统II中心数量大幅减少,并损害了从天线色素(藻黄质、叶绿素a、叶绿素c)到光系统II的能量转移,但对光系统I没有影响,这表明在这种phyophyte物种中,就像在菠菜中一样,光系统II是主要的受损部位。光系统II中含有QB质体醌结合位点的32kDa D1蛋白在光下持续快速翻转,其速率随光强的增加而增加。Greenberg等人(1989)发现降解的量子产率在光谱的UVB区域最高,这表明该蛋白分解的增强可能与光系统II对紫外线的敏感性有关。
高纬度地区的冰川湖,是在冰川退缩后形成的最后一个冰河时代的结束在大约10700年前的美国,许多世纪以来,他们的流域都没有树木覆盖,因此缺乏树叶提供的具有相关颜色的溶解有机物质的供应。基于对加拿大不列颠哥伦比亚省湖泊沉积物的古生态学分析(化石藻类色素、有机质含量),Leavitt et al.(2003)得出结论,在湖泊存在的第一个千年里,紫外线辐射使藻类丰度降低了十倍。
在进化的过程中,有一些水生植物有真菌素类氨基酸(MAAs,第3章)的形式获得了一定程度的抗紫外线保护,这种化合物吸收紫外线的峰值在300到360纳米区域。Shick和Dunlap(2002)回顾了它们在海洋生物中的分布。它们存在于原核和真核浮游植物中,但并非所有物种都具有它们。开花鞭毛藻形成MAAs的能力特别强,在强光下生长的细胞浓度比在弱光下生长的细胞浓度高许多倍一些硅藻物种不积累这些化合物。南极培养的五种硅藻表现出很少或没有合成MAAs的能力,即使暴露在高水平的紫外线下,与此相反,南极的prymnesphyphys Phaeocystis却能形成这些化合物海洋蓝藻,即Trichodesmium,在营养贫乏的热带和亚热带海洋中形成广泛的表面开花,因此暴露在强烈的太阳辐射下,含有特别高水平的MAAs,是已知的自由生活的浮游植物中含量最高的在大型植物中,MAA的合成在红藓科植物中普遍存在,而在绿兰科植物中较少。一些通常不会遇到中波紫外线的深水红藻种类缺乏产生maas的能力Phaeo-phytes不合成MAAs,但可能不需要合成MAAs,因为褐藻含有吸收紫外线的酚类化合物:在西班牙南部的潮间带褐藻Cystoseira tamariscifolia中,Abdala-Diaz等人(2006)发现,随着2月至6月日综合辐照度的增加,菌体中的酚类化合物水平增加了约4倍,然后随着6月至11月辐照度的降低,酚类化合物水平下降了近50%。 In those algae that can make MAAs, there is a general tendency for the amounts formed to increase with UV exposure. In coral reefs the concentration of MAAs within the coral colonies decreases with depth.337
水生黄色物质强烈吸收紫外线。因此,我们可以预期光抑制在颜色更多的水域中不那么明显:在gilvin含量高的高产热带海洋水域中观察到这种情况。735出于同样的原因,在颜色较深的水域(即大部分内陆水域),光抑制似乎主要是由太阳辐射的可见(400-700纳米)成分引起的。
光抑制是由于对反应中心的直接损伤,需要几个小时来修复,除此之外,还有一种光抑制在强光下很快开始工作,在黑暗中相对较快地恢复(在几分钟而不是几小时内)。这一过程涉及光系统II类胡萝卜素成分的可逆变化,称为黄素循环,1482,303,1021,可被视为光合系统对过度强光的有用的适应性反应,而不是内部损伤的症状。在高等植物和大多数绿藻和褐藻中,向光系统II反应中心提供能量的天线色素之一是二氧化类胡萝卜素,紫黄素。当光系统吸收光能的速率接近光化学生成的电子可用于二氧化碳减排的最大值时,类囊体管腔的内部pH值显著下降。这就激活了一种酶,紫黄素去环氧化酶,它会去除第一个环氧O原子,得到单环氧化合物,蒽黄素,然后去除另一个,得到非环氧类胡萝卜素,玉米黄质。玉米黄质吸收的能量不会转移到光系统II反应中心,而是以热的形式消散。当细胞被转移到黑暗中,腔内pH值上升,一种不同的酶,环氧氧化酶,开始发挥作用,这导致玉米黄质氧化,通过添加两个环氧O原子,将其重新转化为紫黄质。在非绿藻中,会发生利用其他类胡萝卜素的叶黄素循环。例如,在硅藻科、金藻科、Haptophyceae和裸藻科中,单环氧化合物二氮杂黄质(图8.12/)和非环氧化合物二氮杂黄质(图8.12/)之间发生相互转化。
在藻类中,无论是浮游植物还是底栖生物,总叶黄素以无光合功能的光保护形式存在,如玉米黄质,其比例随环境光强的增加而增加,并随环境辐照度的变化而变化。Schofield et al.(1998)以墨西哥湾漂浮的远洋褐藻马尾藻(Sargassum natans)为例,发现紫黄质:玉米黄质的比例从04:00小时下降到中午,然后又上升到22:00小时microphytobenthos当它在退潮时暴露在充分的阳光下时,它会调整其叶黄素池的状态。在微型底栖植物群落以硅藻为主的巴罗河河口泥滩(爱尔兰),Van Leeuwe等人(2008)发现,尽管在海水重出后的09:00 h几乎无法检测到二氧化二黄质,但在10:00 h,二氧化二黄质/(硅藻-黄质+二氧化二黄质)比值已上升至^0.2,并在正午时达到最大值,略高于0.3。Stuart等人(1998)在阿拉伯海和温哥华岛(加拿大)附近沿海水域的大量站点的浮游植物种群中发现,非光合类胡萝卜素(如玉米黄质和二氧杂黄质)的比例与叶绿素浓度之间存在很强的反比关系,这表明低营养水域的特征小细胞具有更高比例的光保护性黄-叶绿素色素。在大西洋西北部大陆架断裂附近5 - 75米深度的浮游植物样本中,Prieto等人(2008)发现,光保护类胡萝卜素的比例与细胞在收集时暴露于PAR的辐照度之间存在显著的正相关。
浮游植物光合作用的深度剖面,如图10.4所示,由悬浮瓶法测定,往往高估了光抑制减少初级产量的程度。在自然界中,浮游植物并不被迫长时间停留在同一深度。有些,如鞭毛藻和蓝绿藻,可以迁移到光强更适合的深度(见§12.6)。即使是不活动的藻类也只能在相当静止的条件下长时间保持在同一深度。吹过水面的风会引起称为朗缪尔细胞的循环电流,以著名物理化学家欧文·朗缪尔的名字命名,他是第一个研究这种细胞的人朗缪尔单元是旋转水的水平管(滚动涡),其轴与风向大致平行(图10.5)。相邻的管子以相反的方向旋转,不同直径的管子可以同时出现。风和浪的同时出现对于翻滚涡的产生是必要的,但即使是在小振幅波上的微风也能使它们运动起来。蜂窝的直径可以从几厘米到几百米不等:风速为5米s-1时,一个典型的蜂窝直径可能为10米,表面速度为1.5米s-1.371 Weller等人(1985年)在加利福尼亚南部海岸漂流的FLIP研究平台上进行的测量表明,在相当中等的风速(主要是1-8米s-1)下,通常会产生0.05 - 0.1米s-1之间的下降流。上面的混合层季节性温跃层深度约为50 m, 10 ~ 35 m深度为最强的下降流,对应于混合层的中间区域。在温跃层上下,沉降流一般小于0.05m s-1),在季节性温跃层上下基本不存在沉降流。
因此,很常见的情况是,浮游植物不在强烈光照的表层,而是在混合层中缓慢地循环。Harris和Piccinin(1977)指出北美五大湖月平均风速
-
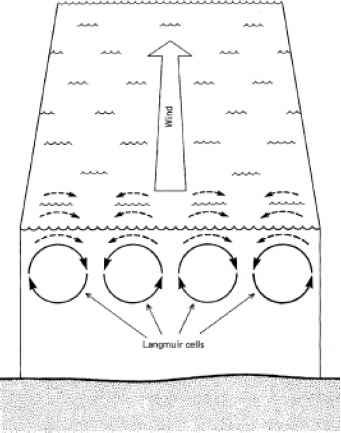
- 图10.5水体中的风致环流(朗缪尔单元)。
整个冬季和夏季的大部分时间,都足以产生朗缪尔细胞,而且在这种条件下,在表面停留的时间不足以产生光抑制作用。当然,在任何给定的月份里,虽然平均风速可能足以保证朗缪尔环流,但也会有一段平静的时期,不会发生朗缪尔环流。冬季从葡萄园湾水域(美国马萨诸塞州)取样的浮游植物在表面光强度下的瓶子中显示出明显的光抑制,但实际上它们很好地适应了在这混合良好的浅海沿海水域中实际遇到的平均光强度
浮游植物的光抑制只可能在水体中经常发生,在这些水体中,高太阳辐照度通常伴随着微弱的风活动,导致表层形成瞬态浅层温度/密度梯度,阻碍了混合,从而将浮游植物困在强烈的近表面光场中。高海拔(3803米)、低纬度(16°S)的的喀喀湖(秘鲁-玻利维亚)就是一个很好的例子。Vincent, Neale和Richerson(1984)发现热行为的典型模式是,近地表温跃层每天早上开始形成,在白天持续,然后在傍晚和整个晚上被风混合和对流冷却消散。近地表的分层持续存在,上层浮游植物的光合作用受到了强烈的抑制。从水中采集的浮游植物样品的细胞荧光能力(据信与功能性光系统II复合体的数量有关)也大大降低,这表明这不是由瓶中固定化浮游植物引起的伪影。Neale(1987)估计L. Titicaca的总水柱光合作用在这些日子至少减少20%。Elser和Kimmel(1985)还利用细胞荧光能力的测量结果表明,在温带地区(美国东南部)在平静的阳光条件下,表层确实会发生光抑制。
总的来说,我们可以合理地得出这样的结论:光合作用在表层的光抑制虽然存在,但并不像原来认为的那样经常发生。在阳光充足、静止的条件下,它可以显著降低区域光合作用,但在有微风时,影响可能很小或没有影响。在需要较长孵育时间的低营养水域,由于使用固定瓶而造成的初级产量低估可能比在生产水域更为严重。然而,应当指出的是,循环决不会总是增加初级生产:正如我们将在下一章中更全面地讨论的那样,深度过深的循环会使细胞长时间处于过低的光强下而不能进行光合作用,从而减少总的光合作用。
继续阅读:吸收光的转换效率
这篇文章有用吗?
读者的问题
-
Modesta2个月前
- 回复
