水生植物吸收光的速率
水生植物的光合作用速率最终必须受到(尽管它并不总是简单地与)高等植物叶片,或多细胞藻体,或单个浮游植物细胞或群落从水下光场吸收量子的速率的限制。在叶片或藻体的情况下,给定波长的量子以特定角度入射到组织表面的特定元素上的吸收率等于E(1,0, f).8s。A(l, 0, f),在那个角度的辐照度,元素的面积,和那个波长和那个角度的吸收率的乘积。总比率光吸收整个叶片或叶体的波长是这个乘积除以所有角度的和入射光对于表面的每一个元素,以及构成叶或叶体总面积的所有元素。
很明显,组织的关键光学特性是吸光度(入射光被吸收的百分比)而不是吸光度。由于穿过组织的光路随角度的变化,叶片或菌体在任何一点的吸收率实际上都会随光的入射角而发生一定的变化。某一波长的总光从各个角度入射时,组织在某一点处的有效吸收率是光场角度分布的函数,因此,严格地说,不可能把某一波长的水下光的某一组织的吸收率与该光的辐射度分布无关。事实上,吸收率通常是用测量光束与光合组织平面成直角来确定的。这被认为提供至少一个近似的量度的吸收,该组织将呈现到光入射在水中。由于厚度的变化,和/或叶绿体的数量和色素组成,在叶片或菌体内,不同地方的吸收率可能会有所不同。长藻体尤其可能是这种情况,它们的不同部分通常暴露在不同的光环境中,例如,因为较低的部分是阴影的。组织内多次散射导致的光子路径长度的增加可以加重多细胞植物的吸收。
图9.3显示了水生高等植物的90°吸收光谱;不同种类的相应光谱多细胞藻类图10.6a、b和c所示。光谱之间的差异部分是由于单位面积叶绿体色素浓度的差异,当然,这在任何藻类类别之间以及不同类别之间都可能有显著差异。然而,光谱形状的一些差异可归因于存在的不同类型的色素。褐藻相对于绿藻和高等植物在500 ~ 560 nm区域的吸收相对较大,这是由于褐藻中岩藻黄质的存在。红藻光谱中520 ~ 570 nm处的宽峰是由于红藻的存在胆蛋白质藻红蛋白。
以浮游植物为例,指单个细胞或群体对来自某一给定波长的光量子的吸收速率
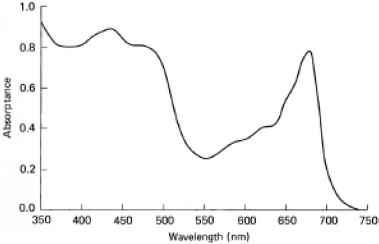
图9.3淡水大型植物叶片的吸收光谱(Kirk,未发表)。光谱是在一片无附生生长的Vallisneria spiralis (Hydrocharitaceae)叶子上测量的,取自澳大利亚ACT的Ginninderra湖,样品细胞靠近光电倍增管:光谱已经过散射校正。
图9.3淡水大型植物叶片的吸收光谱(Kirk,未发表)。光谱是在一片无附生生长的Vallisneria spiralis (Hydrocharitaceae)叶子上测量的,取自澳大利亚ACT的Ginninderra湖,样品细胞靠近光电倍增管:光谱已经过散射校正。
等于E(1,6, f).sp(6, f). ap (l, 6, f),它是该方向的辐照度,细胞或菌落的横截面积(在指定方向)和粒子在其特定方向上对光流的吸收率的乘积。由于细胞或菌落是随机定向的,每个将呈现一个有点不同的投影面积,和吸收率,光在指定的方向流动。每个粒子对这种光的平均吸收率是E(l,9, f). spap。回想一下,spAp是平均值吸收截面粒子的(§9.2)。从细胞或菌落的随机方向可以得出,它们对各个方向的光具有相同的平均吸收横截面。因此,无论水下光场的角度分布如何,我们都可以有效地将平均吸收横截面归因于浮游植物种群。事实上,可以将平均吸光度归因于浮游生物种群中的单个粒子,但这并不是一件有用的事情,因为它是吸光度和横截面积的乘积(它们随方向而变化),而不是单独的吸光度,后者决定了从特定光流中收集量子的速度。
在目前的情况下,我们希望了解关于浮游植物种群的是组成种群的细胞或菌落在光合作用范围内所有波长的平均吸收横截面。对单个细胞或菌落进行测量虽然是可能的,但在技术上是困难的,并且不能给出高精度的结果。因此,我们必须依靠对浮游植物悬浮液进行的光谱测量。浮游植物正常生长的浓度太低,无法进行精确的吸收测量。因此,有必要通过过滤或离心制备更浓缩的悬浮液,然后在较小的体积中重新悬浮。
给定一种浓度合理的浮游植物悬浮液,我们可以通过哪种测量方法来确定平均吸收截面?尽管单个细胞或菌落的吸收率在确定吸收截面方面的重要性,整个悬浮液的吸收率的测量告诉我们关于悬浮液中单个颗粒的吸收特性的相对较少。悬浮液的吸光度光谱随着浮游植物浓度的变化而改变形状,在非常高的浓度下趋于成为一条直线,在整个光谱中Asus«1.0 (总吸收所有波长的光)。然而,如果由于某种原因,我们需要知道的速率,悬浮液的吸收光谱是相关的光吸收通过整个悬浮-例如,在光合效率的实验室研究中。
为了确定悬浮液中每一个自由漂浮颗粒的平均横截面,无论是细胞还是菌落,我们实际上测量的是悬浮液的吸光度Dsus。图9.4显示了三种浮游藻类的悬浮液的吸光度光谱:小球藻(绿色)、舟形藻(硅藻)和联囊藻(蓝绿色)。正如我们前面看到的(eqn 9.2,§9.2),l厘米路径长度的粒子悬浮液的吸光度等于0.434 nspAp,其中n是每毫升的粒子数,spAp是每个粒子的平均吸收横截面。因此,我们可以通过制备适当浓缩的悬浮液,测量任何浮游植物种群在整个光合作用范围内的spAp值吸光度光谱n,应用这个关系式
从400到700纳米的一系列波长。由于路径长度为1cm,那么n,以及每毫升的细胞数,也是每cm2在测量光束路径上的粒子数。因此,在公式9.2和9.5中,N或N可表示单位面积上的粒子数,
-
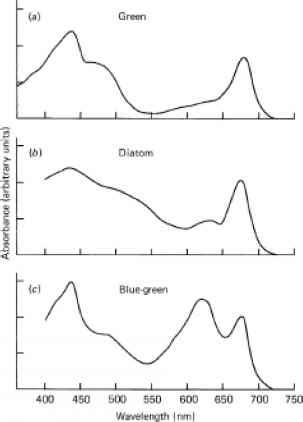
- 图9.4用积分球测量三种浮游藻类培养细胞的吸光度谱(Latimer and Rabinowitch, 1959年之后)。(a)环状小球藻(绿色)。(b)舟形藻最小值(硅藻)。(c)聚囊藻(蓝绿色)。
只要表示面积的单位与表示吸收截面(spAp)的单位相同,即在单位面积上有一定数量的粒子,无论它们通过什么路径长度分布,吸光度都是相同的。
每个浮游植物细胞或菌群在z m深度对波长1的光的平均吸收速率为E0(1,z)。spAp(1),其中E0(1,z)是该波长的光在该深度的辐照度标量,spAp(X)是平均吸收截面,单位为m2。在厚度为Dz m,深度为z m的薄层中,所有浮游植物每水平m2吸收光的速率(W,或量子s-1)为
Ep =£0(1,z)'SpAp(X)。有(9.6)
其中N为每立方米浮游植物细胞或菌落的数量。
在水生初级生产领域,浮游植物浓度通常以mg叶绿素am-3表示,而不是以细胞或菌落m-3表示。从eqn 9.1开始
其中ap(1)为浮游植物的吸收系数,可以写成
式中[Chl]为浮游植物叶绿素a的浓度,单位为mg m-3, af *(1)为每mg叶绿素a m-3浮游植物的比吸收系数:af *(1)的单位为m2mg叶绿素a-1。
在任何给定波段,如果介质各组分的总吸收系数为(1),则浮游植物捕获的总吸收能量的比例为ap(1)/ at(1)。海洋浮游植物在光合作用光谱区域的比吸收系数可在图3.9(第3章)中找到。
在考虑浮游植物的光捕获时,一个有用的概念是存在于某一深度的浮游植物种群对该深度光场在整个光合光谱中的有效吸收系数它可以被认为是浮游植物对PAR的加权平均吸收系数,考虑到PAR在相关深度的实际光谱分布,由
ap(X)Eq(X, z)d1,40°-(9.9)
其中E0(1, z)是波长1和深度z m时单位带宽(nm-)的标量辐照度。我们还可以定义一个特定的浮游植物有效吸收系数af*(z),为浮游植物在1 mgchl am-3时的ap(z)值,单位为m2mgchl a-1。
即使浮游植物的浓度和性质保持不变,PAR的有效吸收系数和比有效吸收系数的值也会随着PAR光谱分布的变化而变化。在海洋中,通常很少有溶解的黄色,随着深度的增加,光场越来越局限于蓝绿色(400-550 nm)光谱区域(§6.2,图6.4)。因为这里是浮游植物的主要栖息地吸收峰(图3.9),af*{z)的值随着深度的增加而增加,在水深范围内可增加50%甚至100%真光区728,940在日本东南的太平洋,Kishino等人(1986)发现âf *(z)随着深度从表面的0.022m2mg chl a-1迅速增加到30米处的0.044。在高产上升流区绿色水体中,af*(z)随深度的增加而减小
图9.5中的显微照片,来自塔斯马尼亚海岸的混合样本,显示了至少一些从水下光场吸收能量的浮游植物细胞的实际样子。
继续阅读:直接测量CO2固定和O2释放
这篇文章有用吗?
