季节性适应浮游植物
季节温度的变化也使对浮游植物的解释变得困难。Steemann Nielsen和Hansen(1961)在一年中每隔一段时间测量了丹麦沿海水域表层浮游植物在当前温度下的光饱和起始参数Ek。它变化了大约三倍,在仲夏最高,在仲冬最低。对比全年Ek、日日照和水温的变化(图12.16)可以看出,光饱和参数的季节变化大部分可归因于温度的变化;然而,春季的Ek值似乎比仅根据温度所预期的要大一些,这可能是由于光合系统对更高的辐照度的适应。
Platt和Jassby(1976)发现,新斯科舍省沿海水域浮游植物的a和P*m值在2.75年的时间内变化了约5倍。测量是在当时的水温下进行的。数值一般在夏季和初秋达到最高,但有时也会在其他时间出现副高峰。统计分析表明,光合能力
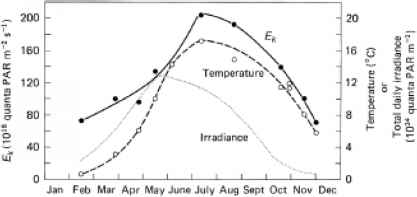
图12.16丹麦沿海站浮游植物饱和起始参数(Ek)、温度和总日辐照度的季节变化。根据Steemann Nielsen and Hansen(1961)的数据绘制。温度(- O-)和Ek(-•-)值为表面层,Ek值是在当前温度下测量的。利用近似因子将辐照度值从勒克司转换为量子m~2s_1。日总辐照度()的值表示全年平均云量的天数。
图12.16丹麦沿海站浮游植物饱和起始参数(Ek)、温度和总日辐照度的季节变化。根据Steemann Nielsen and Hansen(1961)的数据绘制。温度(- O-)和Ek(-•-)值为表面层,Ek值是在当前温度下测量的。利用近似因子将辐照度值从勒克司转换为量子m~2s_1。日总辐照度()的值表示全年平均云量的天数。
(P*m,每毫克叶绿素的光饱和光合速率)与温度密切相关,而a (P - Ed曲线的初始斜率)则不相关。这些发现与已知的光化学过程不敏感,但羧基化对温度敏感是一致的。
在日本的一个池塘中,浮游植物的Ek值在一年中变化了大约三倍,在夏季上升到最大值,在冬季下降到最小值34;然而,这些测量是在当时的水温下进行的。
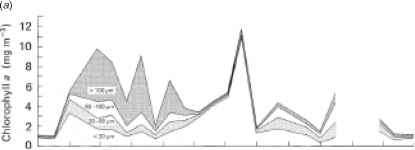
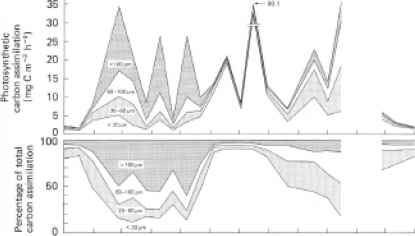
即使考虑到温度的影响,仍然存在一个问题,即要确定种群光合作用行为中任何明显的季节性变化是物种内部真正的个体发生适应,还是仅仅代表了物种存在的变化,因为无论是在海洋中还是在湖泊中,浮游植物种群的分类组成一年四季都有显著的连续变化雷竞技csgo德宾等人的一项研究。(1975)已经表明了不同的相对重要性浮游植物的种类(按大小分开),无论是作为总生物量的组成部分,还是作为初级生产的贡献者,在美国东北部沿海水域的大部分时间里都在变化(图12.17)。较大的电池(从20mm到
一月二月战争四月Mav七月八月Eept十月十一月0«
1973 1972
J.=ri F-jlj MH'四月五月六月七月八月flnpl Qç1 hs-::'.■
1973 1972
图12.17北温带沿海水域中不同大小的浮游植物对总生物量和初级产量的贡献的季节变化(经允许,来自Durbin, Krawiec和Smayda(1975),海洋生物学,32,271-87)。数据来自美国罗德岛的纳拉甘塞特湾。(a)不同粒径组分叶绿素a含量累积曲线图。(b)上图:不同浮游植物大小组分的单位体积光合碳同化累积图。低:光合作用碳同化的不同大小分数表示为同化的百分比由总人口。
J.=ri F-jlj MH'四月五月六月七月八月flnpl Qç1 hs-::'.■
1973 1972
图12.17北温带沿海水域中不同大小的浮游植物对总生物量和初级产量的贡献的季节变化(经允许,来自Durbin, Krawiec和Smayda(1975),海洋生物学,32,271-87)。数据来自美国罗德岛的纳拉甘塞特湾。(a)不同粒径组分叶绿素a含量累积曲线图。(b)上图:不同浮游植物大小组分的单位体积光合碳同化累积图。低:光合作用碳同化的不同大小分数表示为同化的百分比由总人口。
>100 mm),以硅藻为主的冬春季种群占主导地位,而以鞭毛虫为主的小细胞(<20 mm)在夏季种群占主导地位。即使在给定的大小类内,物种组成也随时间而变化:例如,在2月至5月期间的三个丰度高峰中,不同的硅藻物种占主导地位。
加拿大太平洋中浮游植物种群的光合能力沿海入口Hobson(1981)发现,从3 - 4月的极低值迅速上升数倍,在6 - 8月期间达到峰值,然后在8月中旬至9月期间迅速下降,在10月再次下降到极低值。尽管测量是在当时的水温下进行的,尽管任何给定物种的Pm都倾向于随着温度的升高而增加(§11.3),但似乎只有一小部分的变化(~17%)是由温度的变化造成的。4月初和8 / 9月Pm的主要变化与浮游植物分类组成的变化相一致,在光合能力较低时以未知的纳米鞭毛藻为主,在光合能力较高时以硅藻(毛藻、Thalassiosira)或甲藻(Gymnodinium、Peridinium)为主。霍布森认为,在冬季浮游植物中占主导地位的纳米荧光凝胶在基因上适应了短日照和低辐照度的条件。
像这样的情况,浮游植物种群的物种组成不断变化,在淡水和海水中可能是规律而不是例外,因此浮游植物光合特性的任何明显的季节性适应(在考虑温度影响后)在大多数情况下都可归因于现有藻类物种的变化,即是系统发生而不是个体发生的适应。当然,在许多沿海水域全年大量存在的costatum骨架藻(osteonema costatum)等物种确实有可能适应不断变化的辐照值,就像它们在实验室条件下所做的那样,但很难在所有其他物种都存在的情况下证明这一点。更复杂的是,即使在给定的种群中浮游植物物种在一个特定的地理位置,可以有明显的遗传异质性和遗传组成随季节的变化。Gallagher(1980, 1982)通过分析纳拉甘西特湾(RI, USA)分离的海岸硅藻(S. costatum)个体无性系的同工酶模式和生理特征,发现冬花硅藻种群与夏花硅藻种群在遗传上普遍存在差异,尽管它们在遗传上都不是同质的。
在高纬度和高海拔湖泊中,冬季冰下微光下的浮游植物细胞叶绿素含量高于夏季存在的浮游植物,光饱和强度较低。在这样一个例子中,芬兰的Paajarvi湖,不同的藻类种类在一年中不同的时间占主导地位然而,在奥地利的一个高寒湖泊中,物种组成在一年中变化不大,主要由甲藻物种Gymnodinium uberrimum主导,1360,Tilzer和Schwarz(1976)将冰下细胞的叶绿素含量高得多(2 - 4倍)和Ek值低得多归因于物种内部的实际适应。
浮游植物相对短期的光合适应的证据,在几天的周期内,来自于一些实地研究。Platt和Jassby(1976)发现,新斯科舍省沿海水域浮游植物的a值与前三天的平均太阳辐照度相关。在爱尔兰内湖(Lough Neagh), Jones(1978)发现,占主导地位的蓝绿藻种群的光饱和起始参数Ek与前五天的平均日辐照度呈正相关,即前五天的平均辐照度越高,达到饱和所需的光强度越高。Ek的变化似乎更多地是由于a (P - Ed曲线的初始斜率)的变化,而不是每毫克叶绿素的光饱和率(Pm) (a = P*m/Ek)的变化。由于a = df*fm,这些变化可以合理地归因于单位叶绿素的比平均吸收系数的增加,这与较高光强下细胞叶绿素含量的下降有关(§12.2)。鉴于这些变化发生的时间很短,我们可以合理地假设它们对应于物种内部真正的个体遗传适应,而不是种群结构的变化。
因此,虽然由于物种的演替,整个浮游植物种群的光合特性有显著的季节性变化,但在较短的时间尺度上,在它们作为种群重要成员持续存在的几周内,个别物种的光合特性也有适应性变化。
继续阅读:有鞭毛的迁移
这篇文章有用吗?