从No到Noz的氧化和莉顿关系
在20世纪50年代早期,Haagen-Smit和他的同事发现光化学空气污染的主要“成分”是VOC和NOx, Blacet认为N02的光解作用是高臭氧水平的来源(见第1.B.3章)。最初,大气中排放的NO转化为N02被认为是由于它与02反应:
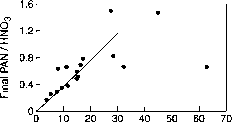
图7.2一系列雾霾室实验中PAN与HNO最终浓度(PAN/HN03)与初始VOC/NOt的比值。HN03既包括气相的气体,也包括估计吸附在室壁上的气体(来自Spicer, 1983)。
图7.2一系列雾霾室实验中PAN与HNO最终浓度(PAN/HN03)与初始VOC/NOt的比值。HN03既包括气相的气体,也包括估计吸附在室壁上的气体(来自Spicer, 1983)。
事实上,这种反应可以很容易地通过将相对高(即~Torr)浓度的NO与空气混合来证明。无色的NO迅速转化为棕橙色的N02,随着反应放热的释放,人们可以感觉到反应容器是温暖的。
尽管反应(1)经常被错误地引用为大气中NO转化为NOz的原因,但基本反应动力学可以用来证明情况并非如此。即使在高度污染的大气中,NO转化为N02也需要几个小时的时间。反应(1)在NO的气、液相中均为动力学二级反应(例如,DeMore et al., 1997;刘易斯和迪恩,1994)。遵循第五章a中讨论的约定。1、反应(f)的速率定律可以写成:
由于NO为二级反应,NO氧化成N02的速率随NO浓度的降低而降低1 / fOO10倍.
室温下三阶速率常数的推荐值为kt = 2.0 X 10~3X cm6分子“2 s~ 1”(Atkinson et al., 1997a)。例如,在1torr NO下,1atm空气中的初始氧化速率约为每分钟40%,而在1mtorr下(1atm, 298 K下为1.3 ppm),仅为每分钟0.04%(另见问题1)。因此,在一些污染地区发现的峰值浓度为0.1 ppm的NO浓度下,速率太慢,无法与观测到的小时尺度上的N02转化相一致。
然而,反应的二阶性质(I)确实为某些NO的排放提供了定性诊断发电厂、冶炼厂等。偶尔,在烟囱出口上方短距离处可以看到NOz特征的橙棕色羽状物。在这种情况下,排出烟囱的NO浓度足够高,它通过反应被02迅速氧化为NOz(1)(见问题2)。在较低浓度下,NO被烟羽边缘的03氧化也很重要,氧化率高达20% /分钟(例如,见Cheng等人,1986)。
然而,在大多数情况下,这样的羽流是不可见的,因为NO浓度足够小,反应(f)非常缓慢。一旦在f950中发现了这一点,难题就在于确定导致NO转化为N02的反应。正如l.B和6章所讨论的,现在已知氢过氧和烷基过氧自由基氧化剂是:
H02和R02的来源将在第六章讨论。
在只含NO、N02和空气的假设大气中,即不含有机物,控制NO和NOz浓度的反应为(4)、(5)和(6):
NOz + hv(\ < 420 nm) -> NO + 0(3P), (4)
继续阅读:No2 o2
这篇文章有用吗?