Sav so2 h2o hso so32
硫的氧化形式(即硫酸和硫酸盐)处于+6氧化状态,因此通常被称为S(VI)。
在(11)-(13)所表示的平衡中,单个反应相对较快(Martin, 1984)。
10-1 10-2 10"3 10-4 10-5 10"6 10~
10-1 10-2 10"3 10-4 10-5 10"6 10~
01 23456789 1011 12 pH值
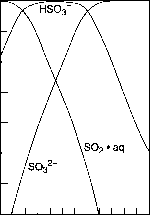
图8.7不同酸度下溶液中硫的摩尔分数(改编自Martin和Damschen, 1981)。
01 23456789 1011 12 pH值
图8.7不同酸度下溶液中硫的摩尔分数(改编自Martin和Damschen, 1981)。
例如,水合S02的解离速率常数kn为3.4 X 106 s”1,因此水合S02的解离半衰期仅为0.2 /as。类似地,第二次电离反应(13)发生在不到一毫秒的时间尺度上(Schwartz和Freiberg, 1981)。因此,无论S02•H20、HSO^或SOj~这三种物质中的哪一种是任何特定氧化的实际反应物,在实验室条件下平衡将相对迅速地重新建立,在大气条件下也可能如此。后者由于液滴的大小、撞击液滴表面的气体S02被吸收的效率、气溶胶表面的化学性质等因素而变得复杂;例如,液滴上有机表面膜的存在会阻碍S02从气相中吸收。
根据平衡(11)-(13)和勒夏特列原理,液滴酸性越大,平衡向左移的越多,即溶解的S02越少。图8.8显示了在0.2-200 ppb浓度和0-6 pH范围内,水溶液中溶解的S(IV)浓度与气相中的S02处于平衡状态。可以看出,S(IV)的浓度范围很广,从~10”9到10”3 mol L”1,取决于pH值和气相中S02的浓度。正如预期的那样,水相S(IV)浓度随着pH值的下降而下降。
S(IV)浓度对液滴pH值的依赖性在决定哪种氧化剂主导S(IV)氧化方面起着关键作用。稍后将更详细地讨论,各种水相反应的速率对ph值有不同的依赖关系。有些速率系数随ph值的增大而增大
-
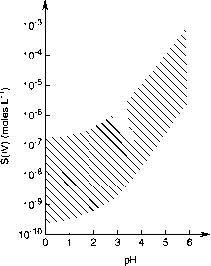
- 图8.8气相S02浓度为0.2-200 ppb时,预期S(IV)水溶液浓度随酸度变化的范围(改编自Martin, 1984年)。
pH值增加(如03),而其他(如H202)则呈现相反的趋势。
在图8.9a所示的第一种情况下,S(IV)的速率常数和溶解度都以同样的方式随pH变化。因此,这样的反应产生S(IV)的总速率,即&[S(IV)], k [S(IV)]
继续阅读:没有Nwv
这篇文章有用吗?
读者的问题
-
丹妮拉freytag2个月前
- 回复
