植物化合物及其作为土壤有机质的转化与稳定
Gerd Gleixner, Claudia J. cimczik, Christiane Kramer, Barbara Lühkcr和Michael W.I. Schmidt
马克斯·普朗克·因斯里努
生物地球化学,fcna,德国
1.介绍201
2.土壤有机质形成途径
3.土壤有机质的稳定
4.土壤有机质周转
5.结论213年
引用213年
1.简介
大气中CO的增加,是因为化石燃料排放被认为是全球气候变化的主要驱动力。raybet雷竞技最新土壤有机质(SOM)有望成为这种碳的重要汇(Ciais et al., 1995;丢弃,1995;Steffen et al., 1998)。然而,在较高的平均温度下,如果这个碳汇易于微生物分解,它可能会成为二氧化碳的额外来源。要了解SOM的稳定与分解之间的复杂相互作用,不仅要研究土壤有机质的周转和稳定性,而且要研究土壤有机质的化学性质。
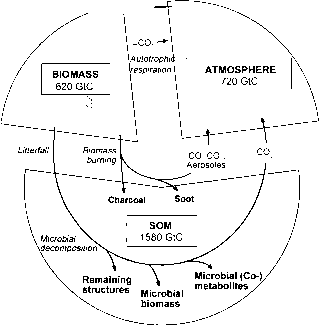
由大气COz光合作用形成的植物生物量是陆地碳循环中的第一个有机底物(图1)。净生物量形成速率估计高达每年1.7 GT(1015 g)碳,而全球活生物量和大气碳库分别为620和720 GT C。然而,植物只能暂时储存这些碳。在衰变过程中,生物质被微生物迅速矿化,只有不到1%的光合作用吸收的CO进入更稳定的SOM池。尽管速率很低,但这个碳池在数百年和数千年的时间里积累了1580gt碳。这比大气和生物碳库的总和还要多。到目前为止,人们对土壤中碳的积累和再动员的控制机制和因素还知之甚少。
下一章将提供引发SOM形成的原生植物生物量形成和分解的基本生物地球化学知识。更好地认识这些植物化学和微生物过程是理解土壤有机质化学及其稳定性的基础。此外,非生物因素和过程,如氧气分压、水、辐射和火,都参与SOM的形成。特别令人感兴趣的是黑碳的形成,例如生物质燃烧和煤烟留下的烧焦物质,因为这些化合物被认为是土壤中最稳定的碳组分。本章将回顾目前关于有机化合物稳定的知识。重点将是分子的化学稳定性,有机分子与粘土或金属(铁或铝)氧化物和氢氧化物的相互作用,以及生物碳稳定的可能性。最后,介绍了现有的SOM周转知识。
2.土壤有机质形成途径
2.1生物量的形成与分解
陆地生态系统中的碳周转主要与三种生物的生化反应有关。初级生物量由自养生物产生,主要是植物。它们的生物质被转化为新的但化学性质相似的消费者二次生物质。它们通过食物链和碳的营养关系联系在一起回收系统。无生命的生物量再次被分解者矿化为二氧化碳、水和矿物质。基本的生化途径,如糖酵解、戊糖-磷酸循环(卡尔文循环)和克雷布斯循环,对所有生物来说几乎是相同的。只有几个主要的生化途径产生生物质生产的代谢物,特别是细胞壁。
光合作用有限,
异养呼吸
异养呼吸
图1土壤有机质形成的主要过程、池和通量
碳水化合物
脂质
木质素、单宁
能源
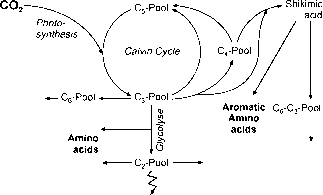
图2导致碳水化合物、木质素、脂质和其他代谢物的生化途径和池的方案。
碳水化合物
脂质
木质素、单宁
图1土壤有机质形成的主要过程、池和通量
对所有生物来说,最重要的是碳水化合物代谢,它为繁殖和生长提供代谢能量。碳水化合物代谢的中心部分是中间碳池(图2),初级同化物进入,糖酵解分解为能量和二氧化碳开始。该池还提供前体,通过C6池聚合结构(纤维素)和存储(淀粉)化合物,并为光合CO的再生,受体,C5池卡尔文循环.来自卡尔文循环的其他中间产物,例如,来自C4池的中间产物,以及来自C池的中间产物,生成C6-C3池(苯丙烷)。这个池是生产芳香族和酚类化合物(如木质素)的起点。
能源
图2导致碳水化合物、木质素、脂质和其他代谢物的生化途径和池的方案。
C2池也是糖酵解分解的一部分,是脂质合成的起点。相比之下,氨基酸有几种前体,它们与一系列的池和代谢途径有关。为了了解生物体之间的结构和化学相似性以及可能的差异,更详细地描述了以下生化基团:碳水化合物、苯丙烷及其相关衍生物、氨基酸、脂类和主要细胞壁成分。
2.1.1碳水化合物
碳水化合物是代谢的初始碳和能量来源,因此是生物生命最重要的代谢物。它们涵盖了广泛的分子,主要由5个(戊糖)或6个(己糖)碳原子组成,形成含氧环结构(图3)。它们的聚合程度与不同的细胞和生物功能有关。单糖,如葡萄糖,是细胞的可溶性糖,直接参与代谢反应。双糖,如蔗糖,经常参与碳水化合物的运输
呵呵
呵呵
CH,哦
CH,哦
CH,哦
CH,哦
CH,哦
CH,哦
CH,哦
CH,哦
CH,哦
图3重要碳水化合物的化学结构。葡萄糖(左)、纤维素(右上)和甲壳素(右下)。
在植物。自然界中最丰富的是多糖(图3),如纤维素淀粉、半纤维素和辣椒素。纤维素和淀粉是葡萄糖的聚合物,半纤维素是其他己糖和戊糖单位的聚合物的混合物,辣椒素是由葡萄糖的含氮衍生物形成的(图3)。大多数这些聚合物要么形成细胞结构,要么被用作储存化合物。多糖是植物和微生物细胞壁的主要结构成分;在微生物中,它们与脂质和蛋白质有关。一些碳水化合物优先存在于微生物中,如己糖,而戊糖如阿拉伯糖或木糖是植物的典型成分。
一般来说,碳水化合物是快速分解的,因为它们是能量代谢的一部分。因此,在植物中,纤维素受到其他化合物的保护而不被分解。纤维素纤维被半纤维素包围(Barton el al., 1999),半纤维素表面还包裹着木质素,木质素对代谢分解具有很强的抵抗力(Paul and Clark, 1996)。此外,非酶褐变反应(美拉德反应)稳定碳水化合物形成羟甲基糠醛从糖和氨基酸。
2.1.2丙苯
C6-C5池的衍生物是生物体最重要的二级产物。它们参与组织的稳定,特别是木质素,在植物的化学通讯和重要的电子传递过程。最丰富的是木本植物中的木质素和没食子酸的衍生物(单宁)。
2.1.2.1木质素
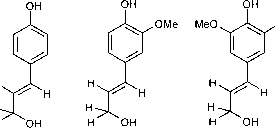
除了纤维素,木质素是木材中最丰富的成分(Killops and Killops, 1993)。木质素的产生是陆地生物特有的,在生长过程中稳定植物组织。它由C6-C中三种不同的醇组成,即香豆醇、针叶醇和辛纳醇(图4)。它们在木质素中的相对丰度表明不同
-
- 图5木质素的部分结构,木质素是由苯丙烷衍生物单位(图4)在植物内通过冷凝和脱氢而建立的多酚。冷凝点,通过醚的木质素前体,和C-C键。根据《Killops and Killops》(1993)修改。
植物类型;例如,针叶树主要以针叶树为单位,而辛纳醇只存在于木质素中落叶乔木.木质素的三维网络是由聚合法形成的自由基单体的。在这种非特异性反应中,主要是醚键和C,-基团形成共价交联,但另外还形成了更稳定的C-C键(图5)。
木质素只能被高度专门化的生物分解,例如,白腐真菌,得名于白色纤维素的残渣。木质素分解者具有特定的酶,即木质素过氧化物酶、锰过氧化物酶和漆酶,它们催化最强的生物氧化(游离氧自由基)。它们将苯酚结构降解为CO,但碳不用于代谢反应(共代谢分解)(Fritsche, 1998)。一旦木质素被分解成单体,微生物就能接触到受保护的碳水化合物。由于使用氧化酶进行分解需要分子氧,因此木质素主要在陆地环境中分解。在海洋系统中,木质素仍未分解。因此,它是陆地输入的生物标志物。
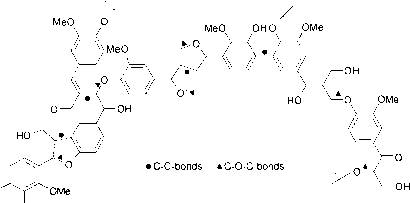
图4木质素前体香豆醇(左)、针叶醇(中)、辛纳醇(右)的化学结构。
图4木质素前体香豆醇(左)、针叶醇(中)、辛纳醇(右)的化学结构。
-
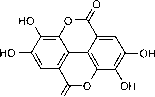
- 图6单宁的化学结构:没食子酸(左)、鞣花酸(中)、毛黄素(右)。
2.1.2.2单宁及其相关化合物
单宁在自然界中广泛存在,但含量不如木质素丰富。它们是植物化学防御和引诱系统的一部分,这使得它们对食草动物来说不那么美味。它们的化学成分用于化学轴系分类。单宁酸是多羟基芳香族酸,尤其是没食子酸或鞣花酸,它们像木质素一样,通过C6-C池产生(图6)。一般来说,这些化合物对微生物的攻击具有抗性。
类似的结构和功能在蒽醌中也有发现,如emoldin。它们存在于高等植物组织中,特别是树皮、心材和根中,但也存在于包括真菌、地衣、维管植物和昆虫在内的一系列生物体中。
2.1.3氨基酸
氨基酸是生物体的重要元素,因为它们是蛋白质合成和酶的底物。微生物还释放氨基酸作为外酶,将细胞外的复杂有机物降解为更小的可消化单体。具有共同a-氨基酸结构的氨基酸来源于不同的代谢途径(图7)。生物体内和土壤有机质中的氮大多以氨基的形式存在。与植物和动物细胞壁相反,氨基酸是微生物细胞壁的主要成分。在这里,它们与碳水化合物结构相连,形成糖蛋白、蛋白聚糖和肽聚糖。
蛋白质和酶很容易被水解肽链的蛋白水解酶分解。因此,酶通常受到二次糖基化的保护,这是细胞通讯的一个组成部分。由于氮通常是陆地生态系统的一个限制因素,大多数生物都储存这种限制元素;例如,一些微生物以y-氨基丁酸的形式储存氮。
Suberin,各种萜类化合物,如类固醇或hophopoids,以及四吡咯色素,如叶绿素。脂类通常是高度特异性的生物标记物,用于分类。
2.1.4.1甘油酯
甘油由甘油组成,甘油是一种来自C的醇,它与三种脂肪酸酯化(图8)形成脂肪作为能量储存。在磷脂中,一种脂肪酸被磷酸.磷脂形成膜,将细胞的内部部分与周围环境隔离开来,因为它们是双分子层。脂肪酸的疏水烷基链指向双分子层的内侧,亲水磷酸盐末端形成膜的表面。膜对于细胞功能是最重要的,因此是所有生物的一部分。膜中脂肪酸的组成是特定于来源生物的,因此被用来描述微生物群落结构(Olsson, 1999)。
2.1.4.2萜类化合物
分支异戊二烯单元是萜类化合物的基本结构,也是由C2池合成的。较少凝结的结构被用作挥发性信息素,例如茉莉酸、薄荷醇或樟脑,或作为天然橡胶材料。更浓缩的结构,如类固醇和hopanoids是膜的一部分,影响其流动性。它们也对其源生物具有高度特异性。最著名的是胆固醇(在动物和植物中)、麦角甾醇(在真菌中)和芸苔甾醇(在硅藻中)。除了纤维素,藿类是最丰富的生物分子。
羧基羧基
h2n - c-h h2n - c-h r ch2oh
2.1.4脂质
脂类包括各种各样的物质,它们都可溶于非极性溶剂,如己烷或氯仿。它们主要是从C2池中使用两种不同的途径合成的。一种途径产生长链分子,如脂肪酸或醇,另一种途径产生支链萜烯。最重要的物质类别是甘油酯及其成分,如脂肪酸、蜡和相关化合物,如角质和
图7氨基酸的一般结构(左)(每种氨基酸的r基不同),氨基酸丝氨酸(右),与肽链相连的氨基酸(右)。
-
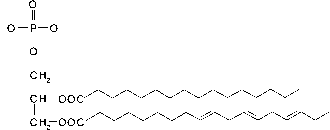
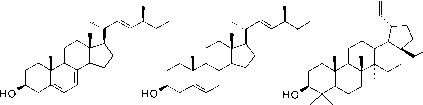
- 图8脂类的化学结构:甘油三酯(上,与一个磷酸基酯化的甘油,一个饱和脂肪酸和一个不饱和脂肪酸单位)和萜类(下,来自真菌的麦角甾醇(左),来自硅藻的芥子甾醇(中),来自植物的藿素(右)。
它们于60年代末在地质样品中被发现(Albrecht和Ourisson, 1969),但在几乎所有生物中都以低浓度存在。
2.1.5陆生植物的细胞成分
陆地生命的发展需要特殊的细胞成分来抵抗大气的影响干旱高氧浓度或风。最后,建立了稳定陆生植物细胞壁的三维木质素网络。为了抵御干旱,进化出了两种不同的策略。植物使用的一种策略是用不透水的疏水化合物(如蜡)来保护外部细胞的暴露部分。微生物使用的另一种策略是使用凝胶状物质作为细胞壁和细胞外聚合物质保持水分。
2.1.5.1蜡
蜡,特别是角质层和橡胶层,是羟基脂肪酸的聚合和交联结构,抗氧化,抗微生物和酶的攻击。角质主要存在于植物组织的外表面,而皮脂主要存在于植物的根和树皮中。两者都含有偶数个碳,范围从Cu到c6。Cutan和suberan也是缺乏酯交联的高脂肪族聚合物。它们由碳水化合物结构连接形成糖脂,糖脂是微生物细胞壁的组成部分(De Leeuw和Largeau, 1993)。
2.1.5.2微生物细胞壁和细胞外聚合物质
生物合成的努力,生物的繁殖和生长,都与新细胞壁的合成有关。在细胞壁外,通常与这些细胞壁成分相似的细胞外聚合物物质产生一个“扩散空间”,锚定外酶。真菌利用甲壳素、葡聚糖甚至纤维素来形成细胞壁,而细菌则使用更复杂的物质,如糖脂、肽聚糖、蛋白聚糖和糖蛋白。糖脂由碳水化合物和脂类组成,而肽聚糖、蛋白聚糖和糖蛋白由氨基酸聚合物和碳水化合物或几丁质组成。后三者的不同之处在于它们的相对组成和交叉连接。它们是高分子量化合物,具有刚性凝胶状结构,稳定了细胞外和细胞内的反应空间。
总结这种生物化学和结构的多样性,很明显,植物的初级生物量主要是碳水化合物,如己糖和戊糖,以及木质素。脂质和氨基酸也存在,但它们通常不那么丰富。相比之下,微生物的次生生物量主要由碳水化合物,如己糖和几丁质,以及脂质和蛋白质组成。有生命的生物量被细胞防御机制保护,例如使用单宁样结构,而无生命的生物量代谢迅速,在不同的营养水平形成类似的生化化合物。只有味道较差的分子,如藿类化合物、单宁酸或抗生素,才不易腐烂。它们数量较少,没有生物适应以它们为食,因为代谢分解的能量成本太高。通常这些化合物是矿化在一个共代谢的方式使用不同的外酶的各种生物。这个过程不提供能量。基本上,原则上,所有的有机物质都能被微生物分解。因此,需要额外的过程来稳定SOM池中的碳。 These are (a) environmental conditions, (b) fires, and (c) the direct interaction of organic matter with mineral particles in soil.
2.2环境条件对SOM形成的影响
环境因素,如环境温度、辐射、水、氧、阴离子和阳离子的可用性直接或间接地影响生物量的衰变。大多数情况下,这些因素是相互关联的。在泥炭地和沼泽中,丰富的水形成厌氧条件,在这种条件下,微生物的代谢转向低能源效率的发酵或硝酸盐和硫酸盐的还原和甲烷的产生。在这些条件下,需要分子氧的芳香族和酚类物质如木质素的分解是不可能的,未降解的生物量积累起来。在潮湿条件下,水和氧的可用性很好地平衡,有机物的分解应该很高,除非生物量的过程受到分解微生物的营养供应或凋落物质量的限制,例如,针叶树的酸性凋落物。在热带地区,高温增加了生物体的呼吸作用,导致基本代谢需要更高的能量。因此,由于SOM的周转率很高,SOM一般不会在热带生态系统中积累。此外,大量的降雨与深度风化的土壤剖面相结合,使溶解的有机质(DOM)能够运输到更深的土壤层,从土壤层向河流运输DOM。
在干旱和半干旱地区,水制约着生物量的产生和衰减。因此,SOM的周转率很低,但侵蚀阻止了SOM在这些地区的积累。在北方地区寒冷的冬天炎热干燥的夏季限制了生物量的产生和衰减。生物量的产生是缓慢的,但衰减更慢,因此SOM的缓慢积累发生在上层土壤层。辐射直接影响生物量的衰变,从水中形成氧自由基。该机制已被发现是北方珍珠石中DOM氧化的重要因素(Bertilsson etal, 1999)。
2.3炭黑的形成
自然和人工火灾(包括能源生产)是非生物分解生物质的重要因素。火灾发生在几乎所有的生态系统中,原因是自然闪电,主要是在炎热和干燥的天气,或由于人为活动,特别是开垦土地。火灾的有机残留物是顽固的结构,如木炭和烟灰,两者通常被称为黑碳(BC)。木炭是生物质燃烧后的固体残留物,而煤烟是在火的气相中产生的。20世纪80年代全球BC产量估计为每年0.04-0.6 Gt来自植被火灾,每年0.007-0.024 Gt来自化石燃料燃烧(Kuhlbusch和Crutzen, 1995年)。因此,公元前
初始阶段
阴燃
燃烧的燃烧
气溶胶约2%焦油约5- 11%木炭约2.3 1灰分约5- 10%
气溶胶约占10%
燃烧
干燥和蒸馏
生产
燃烧
图9平均燃烧效率为80wt-%的自然火灾不同燃烧阶段生物质- c的分配。天然气和焦油的数值是根据估算得出的。(《恐惧之边》1993;Kuhlbusch等人1996;Laursen等人1992;Lobert和Warnatz, 1993;Simoneit, 1999)。
表1生物质燃烧排放* |
|||
初始干燥和蒸馏 |
阴燃 |
燃烧的 |
发光的 |
水(ILO) |
一氧化碳(CO) |
二氧化碳(CO:) |
二氧化碳(CO) |
甲烷(CH4) |
乙炔(C: H:) |
||
醇 |
Non-methane碳氢化合物 |
一氧化碳(CO) |
|
(NMHC,主要为单不饱和Ci_7) |
一氧化氮(NO) |
||
醛 |
多环芳烃(PAHs) |
一氧化二氮(N,0) |
|
萜烯 |
氨(Nil,) |
氮(N) |
|
氰化氢 |
氰(机构) |
||
乙腈(CH.CN) |
二氧化硫(S02) |
||
氰(机构) |
气溶胶 |
||
胺,杂环,氨基酸 |
(40 wt %烟灰) |
||
氯甲烷(CH,C1) |
|||
硫化合物 |
|||
(ils, cos, dms, dmds) |
|||
气溶胶(4 wt %烟灰) |
|||
“化合物的最高数量是在阴燃阶段产生的,而(CHNS-)排放量的最高数量来自火灾的燃烧阶段(根据Lobert和Warnatz, 1993 #5967进行修改)。
“化合物的最高数量是在阴燃阶段产生的,而(CHNS-)排放量的最高数量来自火灾的燃烧阶段(根据Lobert和Warnatz, 1993 #5967进行修改)。
在几乎所有生态系统的土壤中都能找到(Goldberg, 1985;施密特和诺克,2000年;Skjemstad et ai, 1996)。
燃烧过程本身相当复杂,主要产生挥发性产物(50-100%),例如气体和气溶胶;在较低程度上,固体残留(0-50%),例如灰烬、木炭和焦油。这些产物的组成和产量由燃料性质和燃烧过程本身决定,例如,温度、氧气浓度和燃烧阶段。整个过程可分为三个主要阶段(图9)。在初始阶段(高达127°C),燃料通过蒸馏干燥。水和其他高挥发性化合物,主要是脂类,会损失(表1)。在第二阶段,BC是在阴燃或燃烧的条件下产生的,这取决于温度和氧气浓度。在温度高于500°C和高氧浓度的最后阶段,BC再次燃烧成co2和CO。
阴燃条件(低于300°C, 5-15 vol. % O)主要产生气溶胶和气体。后者是处于不同氧化阶段的低分子量分子的混合物(表1),而气溶胶则是更复杂的分子,通常对燃料类型具有高度特异性(Simoneit, 1999)(表2)。它们可以是由气体释放的未改变的燃料成分汽提或热调节解吸(主要来自脂类)或热较少改变的热裂解产物(主要来自碳水化合物和木质素)。相应的过程是脱水和氧化导致解聚和破碎反应。此外,分子,如较少凝结的多环芳烃(PAH)、二恶英或煤烟是重新合成的(Lobert和Warnatz, 1993;Simoneit, 1999)。
燃烧条件(>300°C, >15 vol. % 02)形成完全氧化的气体(表1)。燃料的高分子量物质
复合组 |
植物源 |
产品属性 |
单糖 |
纤维素 |
热了 |
(例如,左旋葡聚糖) |
||
Methoxyphenols |
木质素 |
热了 |
氨基酸,胺,杂环 |
蛋白质 |
热了 |
(1/3的燃料氮以颗粒形式排放) |
||
正烷烃 |
Epicuticular蜡 |
自然 |
/ i-Alkenes |
Epicuticular蜡/脂质 |
热了 |
/ / -Aikanoic酸 |
内部脂质物质 |
自然 |
/ i-Alkanols |
Epicuticular蜡 |
自然 |
Ditcrpcnoids |
裸子植物树脂,蜡 |
自然/热改变 |
常用药用 |
被子植物蜡,树胶 |
自然/热改变 |
类固醇 |
内部脂质物质 |
自然/热改变 |
蜡酯 |
脂膜,蜡 |
自然 |
三萜酯 |
内部脂质物质 |
自然 |
Poiycyclic芳香 |
多个源 |
热了 |
碳氢化合物(如保留区) |
(裸子植物) |
|
烟尘 |
多个源 |
热了 |
洛伯特和沃纳茨,1993年;Simoneit, 1999年。
洛伯特和沃纳茨,1993年;Simoneit, 1999年。
原始的
-
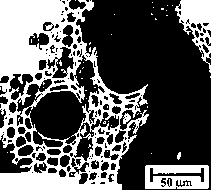
- 图10反射光显微镜下白垩纪-第三纪边界层部分燃烧颗粒的截面(Kruge et til。, 1994)。颗粒显示典型的植物木质部细胞结构。
通过自由基控制热解逐步分解为中分子量焦油产品。焦油部分为火灾提供了能量。它是一种低挥发性热解产物的混合物,主要来自木质素和脂类。根据温度和氧气供应的不同,它们进一步裂解,挥发,完全氧化。此外,热不改变焦油产物的热解吸仍在继续。在火焰中,与自由基形成烟灰的分子重排得到最大化。
植被火灾第二阶段的固体残留物是黑碳,例如木炭和煤烟。木炭是固体燃料阶段的残留物,通常仍然保持燃烧生物质的形态特性(图10)。它的产量主要取决于燃料的木质素含量。从26%到39%的木质素炭产生。最初,硬木中较高的浓缩木质素导致较高的木炭产量(Jakab ct ai, 1997;Wiedemann等人,1988)。木炭主要是在燃烧的条件下生产的(Kuhlbusch和Crutzen, 1995)。
相比之下,煤烟是在火焰中重新合成的。基本的烟灰结构是多层高度浓缩的多环芳烃(图11a, b)。这些多层要么随机定向,要么有序,形成三维“洋葱”结构(图11c,盖子)。形成芳香煤烟结构的初始反应包括游离CH和CH2自由基和中间反应性C(H)分子。导致煤烟分子进一步增长的反应仍是相当推测性的(Lobert和Warnatz, 1993)。同样的构建反应被描述为较少凝聚的PAFIs和富勒烯。然而,像木炭一样,烟灰的形成主要发生在燃烧下,而阴燃会产生更小、凝结程度更低的多环芳烃。
BC在地质时间尺度上被认为是稳定的,因为在65 X 106年的海洋沉积物的不同深度发现了相似颗粒大小的木炭颗粒(Herring, 1985)。此外,BC被发现可以抵抗各种氧化过程,例如湿法化学或热处理(Kuhlbusch, 1995)。然而,最近的碳氧同位素研究表明,BC在土壤和含氧良好的海洋沉积物中降解的时间不超过一百年
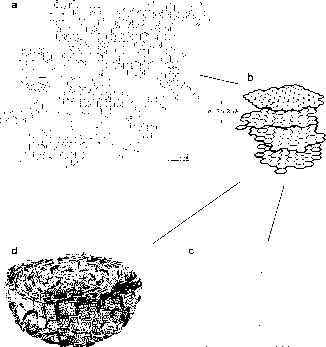
图11烟灰结构为(a)在实验室产生(Sergides et ni, 1987),形成(b) 3-4层的基本结构单元(Heidenreich et al., 1968), (c)随机定向的基本结构单元,以二维表示原理图, (d)具有几个凝结种子的洋葱型颗粒(Heidenreich et ai, 1968)。
图11烟灰结构为(a)在实验室中产生(Sergides et ni, 1987),形成(b) 3-4层的基本结构单元(Heidenreich et al., 1968), (c)随机定向的基本结构单元,显示为二维示意图,(d)具有若干凝结种子的洋葱型颗粒(Heidenreich et ai, 1968)。
tury (Bird et ai, 1999;Middleburg et al, 1999)。自由基机制,例如光化学(Ogren和Charlson, 1983)或微生物共代谢分解(Shneour, 1966;Winkler, 1985),被认为是BC退化的原因。在各种土壤中发现了相应的分解产物,如苯聚羧酸(Glaser et al., 1998;Hayatsu等人,1979)。然而,观察到的BC的长期稳定性和提出的降解反应仍然知之甚少。
3.土壤有机质的稳定
通过生物和热过程,植物生物量的形成和降解产生的分子在其本质或化学稳定性上有所不同。更稳定的化合物可能保存在SOM的起源中,而其他化合物则再次转化为生物质。此外,SOM与土壤基质(如矿物颗粒、金属氧化物和氢氧化物)的相互作用可能会稳定该池中的碳。粘土矿物在封闭环境中形成稳定的聚集体,或在粘土矿物内外表面吸附分子,都可能降低外酶的作用。然而,有机物的吸附不是本章的重点。然而,目前对个别稳定机制的重要性的认识仍然有限。
2.4分子的化学稳定性
分子的化学稳定性通常由物理和生物参数决定。从物理上讲,只有当键断裂所需的活化能可用时,分子才会不稳定。粗略估计,该能量可以来自燃烧热或相应的键能,说明双键和三键最稳定,其次是同极C-C和C-II键。无极碳氧键和碳氮键最不稳定。芳香族和酚系通过易位电子的共振现象进一步稳定。在生物系统中,所需的活化能通过催化分子分解的特定酶而降低。为此目的,酶的“活性中心”在两个反应阶段之间的“过渡态”的几何形状中形成。进一步降低生物键断裂的活化能是通过使用酶分解键的序列来实现的。然而,这一过程需要一整套酶,而这些酶通常只能用于最常见的天然产物。此外,酶催化反应需要特定的分子环境。 This implies that enzymes need to get access to their substrates. Consequently, the decay rate for polymeric substances is often slower than that for single molecules.
这些相互作用可以用14c标记的单体和聚合物化合物来说明(图12)(Azam et al., 1985)。碳水化合物、脂类和蛋白质降解迅速。大多数生物都有一整套的酶来完全降解这些主要的代谢产物,并产生代谢能和代谢物。此外,单体木质素成分矿化迅速。即使碳被标记在更稳定的芳香族环系统中,大多数碳被作为呼吸二氧化碳回收。在微生物生物量中只发现了少量的放射性,表明外泌酶对环系统的共代谢分解(Azam et al., 1985)。与此相反,当聚合物质被分解时,木质素的稳定性显著提高
10 ch
10 ch
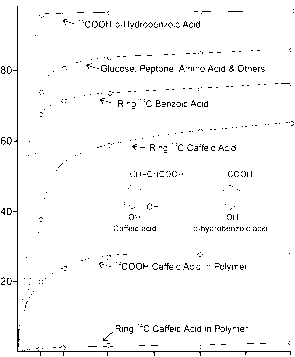
12 4 6 8 10 12
孵化时间[周]
图12 l4c标记木质素模拟物的分解。海德尔和马丁(1975)在保罗和克拉克(1996)。
12 4 6 8 10 12
孵化时间[周]
图12 l4c标记木质素模拟物的分解。海德尔和马丁(1975)在保罗和克拉克(1996)。
使用(图12)。显然,这种聚合结构阻止了外源酶的降解。
对BC的降解也得到了类似的结果。这里认为,抗微生物或光化学降解取决于分子结构的浓缩和无序(Almendros和Dorado, 1999)。主要原因是炭黑内部交联度高。
天然聚合物的长期稳定性可以从地质样品中评估(表3)。除了木质素和单宁的芳香环结构外,甾烷的多芳系
《生物高分子 |
发生 |
保存潜力 |
纤维素 |
维管植物,一些真菌 |
-/ + |
几丁质 |
节肢动物,桡足动物,甲壳动物,真菌,藻类 |
+ |
木质素 |
维管植物 |
+ + + + |
丹宁酸 |
维管植物、藻类 |
+ + +/+ + + + |
Suberans / cutans |
维管植物 |
+ + + + |
软木脂/角质 |
维管植物 |
+/+ + |
蛋白质 |
所有生物 |
-/ + |
Glycoiipids |
植物,藻类,真细菌 |
+ /+ + |
脂多糖 |
Cram-negative eubactcria |
+ + |
在Tegelaar(1989)之后修改的de Leeuw and Largeau (1993)
在Tegelaar(1989)之后修改的de Leeuw and Largeau (1993)
而hopanes被发现对biodégradation有抗性。芳香族系统固有的稳定性使其具有保存潜力。相比之下,suberans和cu-tan的交联结构减少了生物分解。β氧化,通常的机制,这些化合物的分解,被阻止的交联在β位置。
很明显,有两个主要因素控制着有机分子的稳定性。首先,有机分子的固有稳定性稳定了芳香族物质和脂类。其次,生物分子之间的交叉连接抑制了酶的相互作用。只有形成小自由基的反应才能破坏交联结构的键并释放分解产物。
3.2 SOM与土壤基质相互作用的稳定性
另一个稳定SOM的主要机制是SOM与粘土颗粒、金属氧化物和氢氧化物之间的相互作用。SOM含量与粘土、金属氧化物和氢氧根含量明显相关。此外,好氧发酵罐中易分解化合物的周转率远高于土壤(Van Veen and Paul, 1981)和海洋沉积物(Keil et al, 1994)。至少,土壤团聚体的热破坏以及随后的复湿增加了碳和氮矿化率(Gregorich et al, 1989)。然而,这种效应主要归因于微生物碳和氮(Magid et al, 1999)。因此,SOM的稳定可以通过形成封闭环境(聚集体)和SOM吸附到矿物基质(初级颗粒)来实现。
有机物与自由矿物颗粒(沙、粉、粘土)的相互作用可形成微团聚体和大团聚体。微团聚体(直径<250±xm)是土壤的基本结构单元,不受水的破坏,也不受农业活动的影响。微团聚体可形成大团聚体,大于250 /am。微团聚体和大团聚体都包含初级颗粒、有机物和不同大小的孔隙(Tisdall和Oades, 1982)。团聚体的力学稳定性主要由其微生物生物量和水可提取碳水化合物的含量决定(Haynes, 2000)。
初级粒子可以使用超声分散,然后进行重力或密度分离(Amelung和Zech, 1999;施密特等人,1999;Turchenek和Oades, 1979)。大而轻的颗粒被认为代表剩余的植物生物量,而小而密的颗粒则代表高度降解的物质和微生物遗骸(Christensen, 1996;Turchenek和Oades, 1979)。这得到了几项关于SOM含量和组成的独立观测结果的支持,这些观测主要是在A层(图13)。C和N浓度随粒径的减小而增大。土壤中超过50%的C和N存在于粘土部分,超过90%的C和N存在于粘土和淤泥的组合部分(Christensen, 1996)。同时,C/N比值从沙土部分的典型植物值(C/N ~ 40)下降到粘土部分的典型微生物值(C/N ~ 10) (Gregorich et al, 1989)。可水解氮(占总氮的10-40%)主要来自氨基酸和氨基糖(Stevenson, 1982),而在不溶性剩余中,除氨基酸功能外(Knicker et al, 1997),还检测到杂环氮化合物(Leinweber and Schulten, 1998)。 However, the stabilization and the sources of N-containing compounds in soils are only poorly understood. Sand-size particles are dominated by polysaccharides and nonde-graded lignins from plant residues, confirmed by bulk chemical carbon functionality (Baldock et al, 1997; Mahieu et al, 1999) and molecular markers (Guggenberger et al, 1994; 1995; Hedges et al, 1988; Oades et al, 1987; Schulten and Leinweber, 1991; Turchenek and Oades, 1979), whereas lipids are scarcely detected in this fraction. Silt-size fractions are dominated by degraded lignins, whereas plant waxes, microbial lipids, and carbohydrates dominate clay fractions (Fig. 13).
微生物对有机物分解的可利用性可能受到有机矿物相互作用的限制,如吸附在粘土颗粒上或与多价阳离子络合(Oades等人,1988;Sollins et al, 1996)。阳离子酰胺掺入粘土矿物夹层(Huang和Schnitzer, 1986),或形成高度持久性的微生物孢子可能参与了这种稳定(Danielson等人,2000;Kanzawa等人,1995)。在有机溶剂中,SOM形成与粘土矿物相关的有机矿物,而在灰化石中,有机物与铁络合。一般来说,在植被、气候和水文等其他因素相似的情况下,粘土含量与SOM浓度呈正相关(Davidson, 1995)。raybet雷竞技最新然而,最近的研究似乎表明存在一种独特的保护能力,这是单个土壤的特征(Hassink et al, 1997;hasink and Whitmore, 1997c)。一些火山土壤对有机质的稳定影响可能比其粘土含量预测的更大(Parfitt等人,1997年)。这些观察结果可以解释为异硫烷和铁水合体的存在,它们都有一个能够吸附有机分子的大比表面积。
3.3土壤有机质的生物稳定
综上所述SOM的发生和稳定的结果,可以建立一个包括微生物生命周期的SOM周转概念模型(图14)。添加到土壤中的粗的缺氮凋落物将被粉碎机分解,例如,土虱或蚯蚓,变成更小的颗粒。该过程的主要结果是增加了微生物接种的凋落物表面,将纤维素和木质素转化为易于分解和含氮的微生物生物量。接种是在这些动物的内脏中进行的。在自然界中,这些接种过的粪便通常会被第二次“食用”,以获得转化后的食物。白蚁例如,蚂蚁有“真菌花园”来消化生物量。微生物不能将颗粒直接结合到它们的细胞中。只有氨基酸或糖等小分子才能扩散到细胞中。这意味着大分子在细胞外被外酶消化
有机物/生活
大小
碳水化合物
木质素降解产物
脂质
微生物油脂
蚂蚁
根
线虫原生动物根毛花粉
真菌植物细胞菌丝残留
细菌
微生物是
病毒m]
碳水化合物,木质素,脂类i++ + i +++++
图13碳在生物生命周期中的稳定。
这些酶停留在扩散距离内。因此,在底物接触后,微生物产生粘性碳水化合物(海藻酸盐,细胞外聚合物质),使外酶与底物在扩散空间内紧密接触(图14)。此外,这种“胶水”与土壤矿物质形成稳定的团聚体,将其他微生物排除在该环境之外(图14)。在聚集物内部,有机物将被聚集物形成的生物利用一组外酶(如纤维素酶、蛋白酶、裂解酶)消化。在氧化条件下,非特异性氧化酶还能利用小氧自由基降解大多数化合物。在底物耗尽后,扩散空间的碳水化合物再次被吸收到细胞中,形成高度持久性的孢子。孢子形成后,由于几何形状的变化,团聚体不稳定。聚集体的成分是反弹的自由初级颗粒、吸附的孢子和顽固性有机物(图14)。
这个概念模型解释了现有的实验证据。来自破碎集料的粗颗粒(沙粒大小)主要是未降解的植物遗骸,例如纤维素和木质素。由于纤维素的降解速度比木质素快,在部分降解的木质素中相对富集了较小的沙粒。在粘土大小的颗粒中主要发现微生物细胞和孢子(脂质、蛋白质和碳水化合物)。此外,这还表明,在较小颗粒中富集的氮是微生物的遗骸。只有高度交联的结构和本质稳定的物质才有可能在这个过程中存活下来。这些结果表明,SOM可以被生物稳定:通过细胞防御机制和土壤食物网中碳的储存相结合,积极保护碳不腐烂。为了理解和证明潜在的过程,必须在分子水平上使用适用的示踪剂研究碳的周转。
4.土壤有机质周转
调查SOM周转率的适当示踪剂是14c和
l3C, l2C的两种天然同位素。放射性的14C原子在大气中不断地由太阳辐射形成,从有机化合物中剩余的14C可以估计出它们的年龄。的意思是天然丰度的,3C为常数;然而,l3C/l2C比值的微小变化可以识别有机分子形成的来源和过程。最著名的例子是“重”C4植物和“轻”C4植物之间的同位素差异。C、植物以及食物链的同位素富集。

C \细菌 |
\植物残渣 |
真菌和 |
||
J |
细菌孢子 |
|||
微生物分泌物 |
||||
顽固的 |
||||
真菌的菌丝 |
物质 |
粘土矿物 |
图14土壤有机质不同粒径组分的元素和分子特征及其与有机质的大小关系。
图14土壤有机质不同粒径组分的元素和分子特征及其与有机质的大小关系。
不同类型土壤深度剖面中SOM的14c年龄表明,深层层中SOM的平均年龄在1000 ~ 15000年之间(Bol ct al " 1999;Jenkinson et al, 1999)。在泥炭中,甚至可以确定14c年龄为40000年(Zimov et al., 1997)。然而,这些年龄只是平均年龄,因为在SOM中同时测量了未知比例的旧碳和不断添加的新碳(Wang et al., 1996),因此,即使在上层,也可以发现顽固性物质。到目前为止,无论是在散装化学组分还是在物理组分中,都没有发现比这一平均值年龄大得多的物质(Balesdent和Guillet, 1987;Wang et al, 1996)。最近,化合物特异性的l4C年龄首次表明,陆地生物标记物(脂类)比海洋环境中的大块有机物年龄大10倍(Eglinton et al, 1997)。总体而言,在碳积累速率高或低、周转率低的湿冷生态系统和干热生态系统(见上)中,SOM的平均年龄均最高。相比之下,周转率高的热带雨林平均年龄最低。
此外,由60年代末的大气热核炸弹试验引入的l4C信号可用于研究SOM的周转率。这种信号常见于上部
5厘米的湿冷土壤或干热土壤,表明碳在30年后仍然存在。在高周转率的生态系统中,这一峰值通常出现在较深的视野中。利用建模方法,l4C信号在剖面上的分布表明,热带土壤主要由SOM组成,平均停留时间低于10年(Trumbore, 1993),这与雨林中死亡树木确定的平均停留时间为6年非常吻合(Chambers et al, 2000)。对于温带气候的土壤,使用不同平均停留时间(10raybet雷竞技最新、100、1000年)的SOM池来模拟l4C分布。
碳周转率可以使用自然标记技术,结合植被从“轻”碳植物向“重”C4植物的转变来估计。(Balesdent and Guillet, 1987)。粗颗粒主要是新鲜凋落物,平均停留时间在0.5 - 20年之间,而粘土部分的碳平均停留时间约为60-80年(Balesdent, 1996)。近年来,利用热解产物直接测定分子周转率被应用于植被变化后的SOM (Gleixner et al, 1999)。该技术首次表明单个热解产物的平均停留时间在9 ~ 220年之间。最有趣的是,一些更耐高温的热解产物来自蛋白质。这实际上支持了SOM以微生物碳的形式稳定的可能性,微生物碳要么被积极保护,要么被吸附在金属氧化物上。
5.结论
SOM的周转和稳定性主要取决于环境和生物学参数。生物量生产或分解速率都受到影响。此外,土壤基质和凋落物质量以及火灾频率稳定土壤碳。从研究结果可以看出,生态系统具有不同的稳定SOM的机制,从而导致稳定化合物的化学性质不同。为了更好地理解陆地碳循环中的SOM,并确定“丢失的碳汇”,必须考虑以下几点:
1.SOM的含量主要取决于四个功能:(a)生物量输入,(b)分解速率,(c)保留能力,(d)碳输出。所有这些功能都受环境和生物参数的控制。
2.稳定碳的化学类型是每个生态系统所特有的。因此,同位素示踪剂更适合于了解SOM的周转和稳定性。
3.作为微生物生物量的碳保留与作为“生物碳稳定”的“主动”保护相结合可能是控制土壤碳积累的重要因素。
为了确定相应的过程和机制,我们需要:
1.为了研究稳定化合物和生物标志物的化合物特异性平均停留时间,
2.开发新的土壤碳模型,能够模拟L1C和l4C的分子周转。
这些综合信息将为土壤碳周转提供新的见解,并有助于理解和量化生态系统具体的保留碳的机制。此外,这些信息还可以确定土壤的碳汇能力。
参考文献
Albrecht, P.和Ourisson, G.(1969)。油页岩中萜醇的分离。《科学》杂志,342 - 342。Almendros, G.和Dorado, J.(1999)。腐殖酸制剂生物降解性相关的分子特性。欧元。杨文杰,王文杰,王文杰。
阿梅隆,W.和Zech, W.(1999)。在草地表足类的粒度分馏过程中有机物破坏的最小化。Geo-dermn 92, 73-85。
阿扎姆,E,海德尔,K.和马利克,K.A.(1985)。碳的转化-
土壤中14标记的植物成分与氮-15的固定和再矿化有关肥料.植物和土壤86,15 -26。
巴尔多克,欧德斯,j·M·尼尔森,p·N·斯基恩,t·M·戈尔钦和克拉克(1997)。利用固态K,C核磁共振波谱来评估天然有机材料的分解程度。Atist。J.土壤Res. 35, 1061-1083。
Balesdent, J.(1996)。有机分离对某些栽培土壤碳动力学及其模拟的意义。欧元。中国土壤科学,29(4):489 - 497。
巴勒登、吉列(1987)。天然13C丰度作为土壤有机质动态研究的示踪剂。土壤生物。生物化学,19,25 -30。
Barton, S. D .“Nakanishi, K”和Meth-Cohn, O.(1999)。《综合天然产物化学》第1版,爱思唯尔,阿姆斯特丹。
Bertilsson, S., Stepanauskas, R., Cuadros-Hansson, R., Graneli, W., Wikner, J., and Tranvik, L.(1999)。北方流域生物可利用碳和氮库的光化学诱导变化。水生微生物学报,19,47-56。
伯德,M. I.,莫约,C "维恩达尔,E. M "劳埃德,J . "和弗罗斯特,P.(1999)。a中单质碳的稳定性草原土壤.全球Biogeochem。周期13,923 -932。
波尔,R. A.哈克尼斯,D. D.“黄,Y”和霍华德,D. M.(1999)。英国高地土壤过程对碳同位素分布和周转的影响。欧元。土壤科学,30(4):531 - 531。
钱伯斯、东口、施梅尔、费雷拉、L. V.和梅拉克(2000)。亚马逊中部热带森林死亡树木的分解和碳循环。生态学报(自然科学版)
克里斯滕森(1996)。“碳在初级和次级有机无机复合物”,第97-165页。施普林格,纽约。
夏伊斯,谭斯,P. P.,特罗利尔,M .怀特,J. W. C.和弗朗西,R. J.(1995)。北半球陆地CO的一个大汇,由大气CO的C-13/C-12比值表示。科学269,1098-1102。
丹尼尔森,J. W .“祖罗斯基,K. E .”Twohy, C.,汤普森,R. D .“贝尔,E”和麦克卢尔,F.(2000)。不同枯草芽孢杆菌孢子制剂对陶瓷青霉的回收率和杀孢抗性与AOAC试验结果的比较。/。美国航空航天杂志,33,145 -155。
戴维森,e.r.(1995)。控制无生命有机物的形成和降解的物理、化学和生物过程是什么?在“非生物有机物质在地球碳循环中的作用,达勒姆研讨会报告16。”(R. G. Zepp和C. Sonntag编),第305-324页。威利,奇切斯特。
德列乌,J. R .和拉吉奥,C.(1993)。综述了组成生物体的大分子有机化合物及其在干酪根、煤和石油形成中的作用。在“有机地球化学”(M. H. Engel和S. A. Macko, Eds.),第23-72页。Plenum出版社,纽约。
埃格林顿,t.i.,贝尼特斯-尼尔森,b.c.,皮尔森,A,麦克尼科尔,a.p.,鲍尔,j.e.,和德鲁菲尔,e.r.m.(1997)。海洋沉积物中单个有机化合物放射性碳年龄的变化。科学277,796-799。
费恩赛德,赖尔,n.j,和费尔南德斯,f.m.(1993)。雨林燃烧与全球碳预算:巴西亚马逊地区的生物量、燃烧效率和木炭形成。/。地球物理学。第98号,16733-16743号决议。
弗里切,W.(1998)。“Umwelt-Mikrobiologie。”费舍尔,耶拿。乌尔姆
Glaser, B., Haumaier, L., Guggenberger, G.和Zech, W.(1998)。土壤中的黑碳:用苯羧酸作特殊标记。Org。地球化学,29,811-819。
格列克斯纳,G " Bol, R.和Balesdent, J.(1999)。土壤碳循环的分子研究。快速Coimnun。质谱。13,1278- 1283。
戈德堡1985年出版。“环境中的黑碳。”威利,纽约。
格列高利希,卡查诺斯基,r.g.,沃罗尼,r.p.(1989)。不同程度团聚体破碎后土壤粒度组分碳矿化。土壤科学学报(自然科学版),39(4):349 - 359。
Guggenberger, G., Christensen, B. T.和Zech, W.(1994)。土地利用对土壤颗粒分离中有机质组成的影响。一、木质素和碳水化合物特征。欧元。土壤科学学报,35(4):449-458。
古根伯格,G., Zech, W”和托马斯,R. J.(1995)。热带草原后氧化索颗粒大小的木质素和碳水化合物的变化。土壤生物。生物化学,27,1629 -1638。
海德尔,Iv.和马丁,j.p.(1975)。碳14标记的苯甲酸和肉桂酸衍生物在土壤中的分解。土壤科学。Soc。点。Proc 39, 657-662。
哈辛克,马图斯,陈努,C,戴伦伯格,J. W.(1997)。土壤生物、土壤有机质与土壤结构的相互作用。见:“可持续农业系统中的土壤生态学”。(L. Brussard和R. ferr -rera- cerrato主编),第15-35页。佛罗里达州博卡拉顿的CRC出版社
海辛克,J.惠特莫尔,A. P.(1997)。土壤物理保护模型。土壤科学。Soc。点。J., 61(1), 131-139。
早atsu, R " Winans, R. E " McBeth, R. L " Scott, R. G " Moore, L. P. and Studier, m.h.(1979)。煤中的类木质素聚合物。自然杂志278,41-43。
海恩斯,R. J.(2000)。土壤有机质状况、种植历史、定量方法和样品预处理之间的相互作用及其对团聚体稳定性的影响。医学杂志。Eertil。土壤30,270 -275。
赫奇斯,J. I.,布兰切特,R. A.,威利基,K”和德沃尔,A. 2。(1988)。真菌降解木质素CuO氧化产物的影响:实验室对照研究。Geochim。Cosmochim。学报52,2717-2726。
海登赖希,R. D . " Hess, W. M.和Ban, L. L.(1968)。高分辨率电子显微镜的测试对象和标准。/。达成。Crystollogr, 1,1 -19。
赫林,J. R.(1985)。炭流入北太平洋沉积物:新生代燃烧记录。地球物理学。《一夫一妻》32,419 -442。
黄培民,施尼策(1986)。土壤矿物质与天然有机物和微生物的相互作用。美国土壤科学学会,麦迪逊,威斯康星州。
Jakab, E " Faix, O.和Till, F.(1997)。用热重/质谱法研究木质素的热分解。/。分析的达成。40- 41,171 - 186。
詹金森、梅瑞狄斯、金雅玛里奥、华伦、黄明德、《Harkness、D. D. Bol、R》和科尔曼(1999)。通过测量土壤有机质估算净初级产量。80年生态,2762 - 2773。
Kanzawa, Y " Harada, A., Takeuchi, M " Yokota, A., and Harada, T.(1995)。溶curdlanolyticus sp. Nov和kobensis Bacillus sp. Nov
继续阅读:介绍了硬盘
这篇文章有用吗?







