余氯Vs应用氯
3.16 (106)
3.16(10 - 7)结果
pH值小于7.5在pH值7.5时,HOCl和OCl-的浓度相等,超过这个pH值,OCl-在所有含氯消毒剂中占主导地位。这一现实不仅仅是理论上的兴趣,因为作为消毒剂,HOCl比OCl有效80%到100% (Snoeyink和Jenkins, 1980)。我们现在得出的结论是最佳pH值氯化范围可达7.0。超过这个范围,OCl-占主导地位,消毒效果下降。
Cl2(aq)、HOCl和OCl-这三种物质称为游离氯。尽管Cl2(aq)是一种比其他两种更强的氧化剂,但它并没有多大用处,除非氯化反应是在非常酸性的条件下进行的。
例17.3在pH为6.0时,计算HOCl的摩尔分数。
溶液:在pH值6.0时,Cl2(aq)的摩尔分数几乎为零。由表17.4可知,在此pH下,HOCl与OCl-的摩尔比为31.62。
因此,
HOCl的摩尔分数=
含氯消毒剂浓度表达式。现在我们已经详细介绍了氯的各种反应消毒剂,是时候统一氯的浓度了。按照惯例,这三种物质的浓度用氯分子Cl2来表示。相关的反应如下:
Cl2(aq) + H2O ^ HOCl + H+ + Cl-1 (17.15)
Ca(OCl)2 ^ Ca2+ + 2OCl- (17.17)
从这些反应中,
10mg /L hoci=HOC==135 mg/L Cl2 (1718)
fO mg/L NaOCl = nNcOci = 2-32fi;:5 = 0^5 mg/L Cl2 (17.19)
1.0 mg/L Ca(OCl)2 = CC^ = 440.1 = a99 mg/L Cl2 (1720)
每当提到含氯消毒剂的浓度时,就隐含地提到了上面的方程,这个浓度就是等价的Cl2浓度。当然,氯气消毒液的等效Cl2浓度是Cl2。
由阳光介导的反应。水氯是在阳光下不稳定。阳光含有紫外线。这种辐射为分解次氯酸分子的化学反应提供了能量。水分子分解,首先释放出电子,然后将HOCl中的氯原子还原为氯。总体反应如下:
2HOCl ^ 2H+ + 2Cl- + O2 (17.21)
氧来自于水分子的分解,它把氧原子氧化成氧分子。
之前在阳光下的反应是非常重要的。如果消毒剂要储存在塑料容器中,那么这个容器必须是不透明的;否则,氯气将转化为盐酸,次氯酸将转化为相应的钙盐和钠盐。
例17.4含有50kg NaOCl的次氯酸钠溶液储存在透明塑料容器中。它已经在室外储存了很长一段时间,然后被用来消毒游泳池。消毒效果如何?用什么材料代替消毒?它是多少千克呢?
解决方案:由于溶液储存在室外,在透明容器中,会发生以下反应:
由此反应,容器内无消毒剂存在,消毒效果不佳。答
取而代之的消毒材料是盐NaCl。用于消毒的氯化钠的量是
NaCl-(50) = o^23^3,5;5, -(50) = 39.26 kg Ans
反应与无机物.原水和原水废水、处理过的水和处理过的废水中可能存在的还原性物质有亚铁、锰、亚硝酸盐和硫化氢。因此,这些是可以干扰氯作为消毒剂有效性的主要物质。干扰反应如下:含亚铁:
2Fe2+ - 2Fe3+ + 2e- (17.22)
HOCl + H+ + 2e- - Cl- + H2O (17.23)
2Fe2+ + HOCl + H+ ^ 2Fe3+ + Cl- + H2O (17.24)
与锰:
Mn2+ ^ Mn4+ + 2e- (17.25)
HOCl + H+ + 2e-^ Cl- + H2O (17.26)
Mn2+ + HOCl + H+ ^ Mn4+ + Cl- + H2O (17.27)
亚硝酸盐:
NO- + H2O - NO- + 2H+ + 2e- (17.28)
HOCl + H+ + 2e- - cl - + H2O (17.29)
NO- + HOCl - NO- + Cl- + H+ (17.30)
用硫化氢:
H2S + 4H2O - SO2-+ 10H+ + 8e- (17.31)
4HOCl + 4H+ 8e- - 4cl - + 4H2O (17.32)
H2S + 4HOCl - SO2- + 4Cl- + 6H+ (17.33)
为活性污泥厂这种方法只产生部分硝化作用,这是操作人员经常抱怨的问题余氯不能在流出处得到。其原因是亚硝酸盐与含氯消毒剂的反应产生硝酸盐,如反应(17.30)所示。
例17.5一个小型开发项目的活性污泥厂出现故障,在获得国家机构批准后,决定将未经处理的污水排放到河流中。废水中亚铁含量为8 mg/L,锰含量为3 mg/L,亚硝酸盐为20 mg/L,硫化氢含量为4 mg/L。计算实际消毒前所需HTH的mg/L剂量。氯的浓度是多少?
解:考察反应式(17.22)到反应式(17.33)表明,除了反应式(17.33),参考物质的数量等于2摩尔电子,反应式有8摩尔电子。通过考虑所有其他反应,需要多少毫当量的HOCl
8 3 20 4 8 3 20
+ ..+ " "…+ ____=______...+,。“…+ -
2Fe/ 2mn / 2no2 / 2h2s /8 2(55.8)/2 54.9/2 (14+32)/2
in* n o n* (HOCA。, (1.008 + 16 + 35.5a, t
Ca(OCl)2 ^ Ca2+ + 2OCl-2OCl- + 2H2O ^ 2HOCl + 2OH-
因此,n fi™un!(Ca (OCl) 2^ 0f 40.1 + 2(16 + 35.5) mg/L HTH = 54。°8 ip-^HOC——)= 54.0^2>(1^-+16-+^^.5;
由式(17.20)可知,氯浓度= 73.69(0.99)= 72.95 mg/L
氨与氯胺生成反应的最佳pH范围。
从污水处理厂流出的水可能含有大量的氨,当消毒时,发现的不是游离氯,而是氨的替代品,称为氯胺。此外,在水处理在植物中,氨经常被故意添加到氯中。这也形成了氯胺。氯胺和氯一样是消毒剂,但它们反应慢,正是这种反应慢的特性,才会使用氨。目的是在分配系统中提供残留的消毒剂。换句话说,氯胺的形成保证了水到达消费者的水龙头时,仍有一定数量的消毒剂存在。
氯胺的形成是一个循序渐进的反应过程。当氨和氯注入待消毒的水中时,会发生以下反应,一个接一个,循序渐进。
NH3 + HOCl ^ NH2Cl(一氯胺)+ H2O (17.34)
NH2Cl + HOCl ^ NHCl2(二氯胺) + h2o (17.35)
NHCl2 + HOCl ^ NCl3(三氯胺)+ H2O (17.36)
首先,需要注意的是,该反应是用HOCl表示的。然而,通过反应的等效性,如果想知道其他两种物质的等效量,则可以操纵上述反应。因此,在一氯胺和二氯胺中,氯与氨结合;它们被称为组合氯。在随后的讨论中将说明,消毒过程中三氯胺的浓度几乎为零;因此,它不包括在结合氯的定义中。
反应(17.34)表明,当一摩尔HOCl加入一摩尔NH3时,一摩尔HOCl转化为一氯胺基本完成。然而,鉴于HOCl和OCl-是pH的函数,这种说法并不完全正确。从前面的讨论可知,在pH值7.5时,次氯酸和次氯酸离子的摩尔浓度相等,但超过pH值7.5时,次氯酸离子占主导地位。OCl-不直接与NH3反应形成一氯胺,但必须首先水解产生HOCl反应(17.34)进行。因此,当pH大于7.5时,将1mol HOCl加入1mol氨水中并不能保证完全转化为NH2Cl。在这些pH值下,由于次氯酸盐离子的优势,添加的一摩尔HOCl变得更少。然而,在pH值低于7.0时,HOCl几乎有100种浓度存在;因此,在这个范围内,一摩尔对一摩尔的加成基本上保证了上述转化为一氯胺。
现在,反应(17.35)和(17.36)表明,加入两摩尔的HOCl和三摩尔的HOCl,分别基本上完成了转化为二氯胺和三氯胺的过程。与转化为一氯胺的情况相同,这2摩尔和3摩尔并不是这些值,因为最终的浓度取决于溶液的pH值。pH大于7.5时,转化不完全。
让我们就二氯胺的形成进行更多的讨论。二氯胺的来源NH2Cl中氮的氧化态是-1。NHCl2中氮的氧化态,是+1。这意味着为了形成二氯胺,必须从氮原子中抽离出两个电子。现在,随着次氯酸加入量的增加,观察到的其他物质是氮气和硝酸盐。以氮气为例。N2分子中N原子的氧化态为零。这意味着,为了从NH2Cl中形成氮气,只需要从氮原子中提取一个电子;这个过程比提取两个电子容易。因此,必须得出这样的结论:在二氯胺形成之前,气体一定已经形成了,而且二氯胺要形成,需要的HOCl要比形成气体所需的HOCl多。
生成氮气的反应可以写成:
2NH2Cl ^ N2(g) + 2Cl- + 4H+ + 2e- (17.37)
HOCl + H+ + 2e-^ Cl- + H2O (17.38)
2NHCl2 + HOCl ^ N2(g) + 3CF + 3H+ + H2O (17.39)
让我们讨论一下一氯胺的形成和氮气的形成。氨中氮原子的氧化态是-3。同样,它在nh2cl中的氧化态是-1。因此,从氨中形成一氯胺需要从氮原子中提取两个电子。现在,氮气中氮的氧化态是零,这意味着从氨气中形成氮气需要抽走三个电子;这比提取两个电子要难。因此,在HOCl和NH3的反应中,生成的是一氯胺而不是氮气,并且只有当加入更多的HOCl才能完全转化为一氯胺时才能形成气体。
考虑的形成硝酸根离子.氮在硝酸盐离子中的氧化态是+5。因此,这个离子不会由氨形成,因为这需要抽离8个电子。如果它是由一氯胺形成的,它需要抽走6个电子,如果是由二氯胺形成的,它需要抽走4个电子。因此,在氯胺与HOCl反应中,硝酸盐由二氯胺形成。然而,我们将比较首先由二氯胺形成的哪种形态:三氯胺或硝酸盐离子。三氯胺中氮原子的氧化态是+3。因此,要形成三氯胺,需要从氮原子中抽离出两个电子。这可以比作从氮原子中提取四个电子来形成硝酸离子。因此,三氯胺先于硝酸盐离子形成。
形成硝酸盐离子的反应可以写成:
NHCl2 + 3H2O - NO- + 2Cl- + 7H+ + 4e- (17.40)
2HOCl + 2H+ 4e- - 2Cl- + 2H2O (17.41)
NHCl2 + 2HOCl + H2O - NO- + 2Cl- + 5H+ (17.42)
现在,让我们来讨论一下三氯胺在消毒过程中的最终命运。根据氯胺反应[反应(17.34)到(17.36)],加入三摩尔的HOCl,就会形成一摩尔的三氯胺。然而,事实并非如此。如前所述,当一氯胺以逐步的方式分解转化为二氯胺时,它被破坏成氮气。这样,二氯胺的最终生成量就会减少;事实上,要少得多,因为我们已经发现,气体的形成比二氯胺的形成更有利。此外,一氯胺和二氯胺本身与HOCl反应生成另一种气体N2O [NH2Cl + NHCl2 + HOCl - N2O + 4H+ + 4Cl-]。此外,在由一氯胺最终形成二氯胺之前,可能会发生更多的其他副反应。总的来说,一旦达到了二氯胺转化为三氯胺的步骤,二氯胺的浓度就已经很低,三氯胺的产量也很低。因此,如果三氯胺确实具有消毒电力,这种消毒剂的特性是无用的,因为浓度本来就很低。这就是为什么化合氯只由一氯胺和二氯胺组成的原因。此外,由于二氯胺本身是简单分解的,因此它不是重要的含氯复合消毒剂;一氯胺是。如果目的是生成消毒氯胺,只需将氯添加到略多于一摩尔氯与一摩尔氨的水平,就可以简单地生成一氯胺。除此之外就是氯的浪费。
现在,让我们确定形成一氯胺的最佳pH值范围。确定这一范围的关键是HOCl的优势。次氯酸在pH值小于7.0的范围内占优势;因此,形成一氯胺的最佳pH范围也小于7.0。
例17.6为了在分配系统中提供残留的消毒剂,对处理后的水进行氯胺化处理。如果每摩尔氨加入两摩尔的HOCl,计算产生的氮气的摩尔数。
解决方案:在氯胺化过程中可能会发生如此多的中间反应,以至于不可能确定所产生的物种的确切数量。实验上,样品可以放在一个封闭的罐子里进行氯胺化。然后可以测量释放的氮气;但是在这个问题中,氮的摩尔数是无法计算的。答
与有机氮反应。氯与有机胺反应生成有机氯胺。有机胺的例子有- nh2, - nh -和- n =基团。在与氨反应的同时,HOCl也与有机胺反应,通过氯原子简单地附着在有机分子中的氮原子上,形成有机一氯胺和有机二氯胺。例如,甲基胺与HOCl反应如下:
CH3Cl + HOCl ^ CH3NHCl(一种有机一氯胺,一氯甲基胺)+ H2O (17.43)
与将一氯胺转化为二氯胺一样,在第二步反应中,一氯甲基胺转化为二氯甲基胺,如下所示:
CH3NHCl + HOCl ^ CH3NCl2(一种有机二氯胺,二氯甲基胺)+ H2O (17.44)
其他含氮有机化合物是含有- ocnh2和- cnh -基团的酰胺。氨和有机胺分子基本性质.它们很容易与酸性的HOCl发生反应。另一方面,有机酰胺的碱性比胺低;因此,它们不容易与次氯酸反应形成有机氯酰胺。然而,它们消耗氯,所以有机酰胺和有机胺在氯胺化中很重要。有机氯胺和有机氯胺虽然有一定的消毒作用,但不如氨氯胺;因此,它们的形成是无益的。有机氯酰胺和有机氯胺也是氯的结合物。
例17.7展示有机氯胺作为消毒剂的特性的半反应。
解决方案:含氯消毒剂的一个特点是将消毒剂中的氯原子转化为氯离子。因此,在描述化学反应时,氯化物的形成总是要表现出来的。设CH3NHCl代表有机氯胺。因此,其作为消毒剂的半反应如下:
CH3NHCl + 4H+ + 4e-(来自有机体消毒)^ Cl- + NH+ + CH4
正如这个半反应所显示的,每摩尔消毒剂从被消毒的生物体中夺取四摩尔电子,使生物体失去活性。答
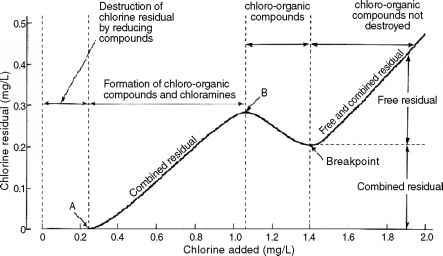
断点的反应。的状态,如图17.1所示氯残留作为一个氯的作用剂量。从开始时的零氯到A点,所加的氯立即被消耗掉。这种消耗是由还原物种如Fe2+, Mn2+, H2S和NO-引起的。这些物质在HOCl上的反应已在前面讨论过。如图所示,在A点之前没有氯残留。
在水和废水中,可能存在有机胺及其分解产物,如氨。此外,氨可以有意地添加,形成氯胺,在分配系统中产生氯残留物。此外,其他有机物质,如有机酰胺也可能存在。因此,从A点到B点,形成氯有机化合物和有机氯胺。氨将在这个范围内转化为一氯胺氯用量.
超过B点,氯-有机化合物和有机氯胺分解。同样,在这个氯剂量范围内,一氯胺开始转化为二氯胺,但与此同时,它也分解为氮气,也可能分解为其他气体。这些分解反应在前面已经讨论过了。
氯胺和存在
氯胺和存在
-
- 图17.1氯残留量与应用氯。
随着曲线从B点开始继续“下坡”,二氯胺转化为三氯胺,在“断点”表示的最低点完成转换。如所示,这个最低点称为断点。此外,二氯胺在达到断点之前也会形成硝酸盐。事实上,一氯胺和二氯胺的分解产物还会形成其他物质,氯-有机化合物和有机氯胺的分解产物也会形成其他物质。
由曲线向下摆动可知,发生在B点与断点之间的反应均为击穿反应。在到达B点之前形成的物质在这个氯剂量范围内被破坏。换句话说,已经形成的有机氯,已经形成的有机氯胺,已经形成的氨氯胺,以及所有其他通过与化合物反应形成的物质,比如酚和富里酸,都在这个范围内被分解。这些分解反应统称为断点反应。
断点反应只分解各自物质的可分解部分。所有不可分解的文件将在断点之后保留。除其他不可分解物外,这将包括残留有机氯胺、残留氯有机化合物和残留氨氯胺。正如我们所了解到的,在这一点上,来自氨氯胺的三氯胺部分必须非常少,才能作为消毒剂。所有可能干扰消毒的物质和所有可分解物都已被破坏,因此,任何超过断点的氯用量都将显示为游离氯残留量。
从“氯残留量与应用氯”曲线中获得了重要的知识。我们已经知道,所有的氨氯胺实际上在断点消失。我们还了解到有机氯胺并不是很好的消毒剂。因此,在分配系统中提供剩余消毒剂时,不应进行到断点的氯化处理。由于最大值与一氯胺氨的最大生成量相对应,理想的做法是在这个点用一定剂量进行氯化。请注意,在图17.1中,相当数量的组合残差仍然存在于断点之外;然而,这些组合残留物主要由组合有机氯和组合有机氯胺组成,组合有机氯胺具有很少或没有消毒性能。正如我们所提到的,三氯胺的浓度非常低。
氯化达到或超过断点的做法被称为超氯化。超氯化确保完全消毒;然而,它只会在分配系统中留下游离氯残余物,这些残余物很快就会消失。
注:如果要进行超氯化以确保完全消毒,又希望氯残留时间长,则应在超氯化后加氨,使氯用量恢复到最大的一氯胺形成点。
例17.8参考图17.1,如果给药剂量为1.8 mg/L,确定所产生的游离氯残留量,所产生的联合残留量,以及所产生的联合氨氯胺残留量。此外,确定结果的有机氯胺残留量。
解法:从图中可以看出,1.8 mg/L用量下的余氯浓度= 0.38 mg/L。断点处残留浓度= 0.20 mg/L。因此,游离氯残留量= 0.38 - 0.20 = 0.18 mg/L Ans组合残留量= 0.20 mg/L Ans组合氨氯胺量- 0 Ans有机氯胺量不能测定Ans
与酚的反应。氯很容易与苯酚和含有苯酚基团的有机化合物发生反应,因为氯原子取代了苯酚环上的氢原子。这些氯化物替代品的气味非常难闻。由于工业排放和有机物质自然衰变的结果,苯酚和酚类化合物可以存在于原水供应中,这些气味物质的形成是水处理厂操作人员关注的主要问题。
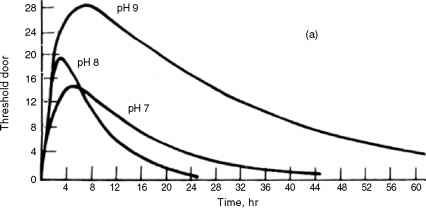
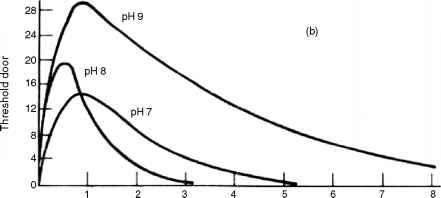
图17.2显示了阈值气味与pH值和氯剂量浓度的关系。图17.2a使用浓度为0.2 mg/L,在pH为9.0时,最大阈值气味浓度约为28 ^g/L。当pH降低到8.0时,该阈值恶化到20 ^g/L左右,当pH进一步降低到7.0时,阈值浓度在13 ^g/L左右变得最差。因此,与高pH值氯化相比,在酸性条件下氯化会产生非常糟糕的气味。这是非常不幸的,因为HOCl在较低的pH范围内占主导地位,这是消毒的有效范围。
在图17.2b中,氯的浓度已增加到1.0 mg/L。对于相同的pH调整,最大阈值浓度与图17.2a大致相同;然而,在pH为7.0和8.0的情况下,阈值气味几乎在接触后约3至5小时消失,而当剂量仅为0.2 mg/L时,阈值气味大于60小时。因此,增加剂量会产生最糟糕的气味。
图17.3为HOCl将苯酚分解为无臭低分子量分解产物的反应方案。各种氯取代酚类化合物的阈值气味浓度也显示在括号中。请注意,最严重的违禁者是2-一氯苯酚和2,4-二氯苯酚,它们的气味阈值为2.0 ^g/L。为了进行这些分解反应,超氯化是必要的,这也意味着气味在消失之前已经增加了。
例17.9在图17.3的反应方案中,邻氯苯酚中的哪个原子被氯原子取代,形成2,6-二氯苯酚?
解:酚环中的氢原子被氯取代了。答
时间,人力资源
图17.2苯酚氯化反应产生的阈值气味:(a)氯0.2 mg/L,初始苯酚5.0 mg/L;(b)氯1.0 mg/L,初始苯酚5.0 mg/L;均在25℃,阈值气味浓度为Jg/L。(摘自Lee, g.f.(1967)。水化学原理与应用“,”S. D.浮士德和J. V.亨特(编)。John Wiley & Sons,纽约。许可)。
时间,人力资源
图17.2苯酚氯化反应产生的阈值气味:(a)氯0.2 mg/L,初始苯酚5.0 mg/L;(b)氯1.0 mg/L,初始苯酚5.0 mg/L;均在25℃,阈值气味浓度为Jg/L。(摘自Lee, g.f.(1967)。水化学原理与应用“,”S. D.浮士德和J. V.亨特(编)。John Wiley & Sons,纽约。许可)。
形成三卤甲烷。氯与富里酸、腐殖酸和腐殖酸等有机化合物的反应产生不良的副产物。这些副产品被称为消毒副产物DBPs。DBPs的例子有氯仿和溴氯甲烷;这些DBPs被怀疑是致癌物。Snoeyink和Jenkins(1980)写了一系列反应,证明了氯仿可能由含有机化合物的乙酰基形成的基本步骤。这些反应如图17.4所示。
注意,最初的反应包括用氢氧离子从甲基中分裂氢原子。在(3),(5),(7)中再次使用了羟基离子。因为涉及到羟基,这意味着氯仿的形成在高ph值下增强。为了防止氯仿的形成,所有这些都是必要的吗
继续阅读:Ci
这篇文章有用吗?
读者的问题
-
极光2个月前
- 回复


