传质数学
在液相和气相之间,质量从一个相传递到另一个相必须通过界面边界面。我们称这个表面上的溶质浓度为[yj表示气相。对应的液相浓度为[xj]。[xi]和[yi]是相同的溶质浓度,只是它们指的是不同的基;实际上,他们是平等的。因为它们相等,而且界面的厚度为零,xi和yi必须彼此处于平衡状态。
想想吸收的过程。若[y]为体相气相浓度,则朝界面边界方向的驱动力为[y] - [yi],传质速率为k,([y] - [yj),其中ky为气膜传质系数。为了使这种传质速率存在,它必须由液膜上的同等传质速率来平衡。液相传质速率为kx([xi] - [x]),其中kx为液膜传质系数,[x]为溶质在液相中的体积浓度。
已知的是[xi]和[yi]处于平衡状态。但是,通过实验来确定这些值是非常困难的。因此,与其使用它们,不如分别使用[x*]和[y*]。[x *]是[x]达到平衡值时所达到的浓度。通过平行演绎,[y*]也是[y]达到平衡值时所达到的浓度。相应的驱动力现在分别是[y] - [y *]和[x *] - [x]。要理解驱动力的物理意义,请参见图9.8。
如图所示,[xi], [yi]在平衡曲线.平衡曲线是当两相之间没有净传质时,液相浓度[x]与气相浓度[y]之间的关系。对于液相和气相中任意一对给定的值[x]和[y],点([xi], [yi])分别表示([x], [y])必须“移动”才能在平衡曲线上同时达到它们的平衡值的“距离”。这个距离用线段([x], [y] ^ [xi], [yi])表示,是传质的实际驱动力;
-
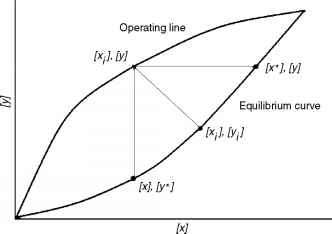
- 图9.8不同摩尔分数之间的关系。
然而,如前所述,([xj, [yj)是无法通过实验确定的。因此,定位点([x], [y*])可查看气膜中的代理驱动力,定位点([x*], [y])可查看液膜中的代理驱动力。
可以看出,[y] - [y*]大于[y] - [yj;然而,这并不是转移的真正驱动力。同样,[x*] - [x]大于[xj - [x],但是,同样,这不是转移的真正驱动力。然而,当写传递方程时,它是一个比例常数的前缀。因此,这种情况是利用使用不同的比例常数的情况下替代驱动力。因此,用Ky作为代入情况下气体侧传质方程的比例常数,Ky (y - yi) = Ky (y - y*) (9.2)
Ky和Kx分别称为气侧和液侧的总传质系数。为了求导,将ky和kx分别称为两侧的传质系数。
确定整体传质系数和个别传质系数的关系式具有指导意义。式(9.2)可以重新排列得到
J_ = [y] - [y *] = ([y] -[一])+([一]- [y *] - = 1 [yj - y [*] (94)
Ky Ky ([y]-[yj) Ky ([y]-[yj) Ky Ky ([y]-[yj)
用式(9.1)替换k^([y] - [yi]),
Kx的平行推导得到
Kx Kx mky mky
坐标[xi]和[yi]是平衡曲线上点([xi], [yi])的坐标。另一方面,坐标[x]和[y]是点([x], [y])的坐标,表示液相中的浓度[x]和气体中的浓度[y]。因为相不在平衡状态,([x], [y])不在平衡曲线上。可以绘制出液相和气相中对([x], [y])的不同值;这个图称为操作线(见图)。任何([x], [y])对都称为工作点。对于工作点([x], [y]),根据代理方程,平衡曲线上对应的点为([x], [y*])和([x*], [y])。点([x*], [y*])只有当([x], [y])在平衡曲线上时才能存在。
之间的斜率([x]、[y *])和([xi], [yj)([一]- [y *]) / ([xj - [x]);这等于m。因此,如果平衡曲线是一条直线,m就是平衡曲线的斜率。
可以对剥离操作进行并行推导;结果相似。唯一的区别是下标和上标可以互换。因此,以下将获得类似的方程:kx ([x] - [xi]) =肯塔基州([一]- [y]), kx ([x] - [xi]) = K ([x] - [x *])和肯塔基州肯塔基州([yJ - [y]) = ((y1 - [y])。从图中可以看出,质量流量是从液相流向气相的。
继续阅读:自来水有多少克
这篇文章有用吗?
