氢化酶体的细胞器,可以使用质子作为电子受体
在线粒体遗迹细胞器形成鲜明对比的是上面所提到的,氢化酶体保留一个ATP生成函数(穆勒1993,1998)。他们划分的终端反应细胞的能量代谢。典型,氢化酶体进口丙酮酸(苹果酸)的氧化脱羧pyru-vate乙酰辅酶a的行动:铁氧还蛋白氧化还原酶(卵圆孔未闭),而不是,如线粒体有氧,行动的丙酮酸脱氢酶(PDH)。琥珀酸琥珀酸酯:CoA-transferase和thiokinase被认为调解乙酸的形成和ATP(穆勒1993、1998),类似的情况的线粒体kinetoplastidae和寄生虫(van Hellemond et al . 1998;Tielens et al . 2002年)。减少等价物期间形成丙酮酸不习惯进行脱羧反应的酶燃料在线粒体电子传递链作为;而是从氢化酶的氢化酶体,从而降低导致质子氢分子的形成(图2;穆勒1993;Embley和马丁1998;马丁和穆勒1998; Vignais et al. 2001). Notably, anaerobic chytridiomycete fungi followed a different evolutionary strategy: they avoid the generation of reduction equivalents by using pyruvate: formate lyase (PFL) instead of pyruvate ferredoxin oxidoreductase (PFO) for the non-oxidative splitting of pyruvate into acetate and formate rendering hydrogen production a marginal metabolic route (Fig. 3; Akhmanova et al. 1999; Boxma et al. 2004). The hydrogenosomes of certain ciliates such as Nyctotherus ovalis, on the other hand, retained a much more mitochondrial-type of hydrogenosomal metabolism (see below). Clearly, hydrogenosomes are not the same (Coombs and Hackstein 1995; Embley et al. 1997; Hackstein et al. 1999, 2001). Therefore, it is necessary to review publications dealing with the various hydrogenosomes in more detail, and, in particular, to discuss the metabolic variants with respect to their potential to support the growth of endo- or ectosymbionts, respectively.
阴道毛滴虫的氢化酶体
滴虫的氢化酶体(Parabasalia)深入研究了30多年(Lindmark和穆勒1973;穆勒1993)。
毛滴虫
乙酸丙酮酸丙酮酸^ = ^ >乙酰辅酶a >醋酸琥珀酸琥珀酰辅酶
j)卵圆孔未闭
ATP ADP
ATP ADP y (3 stk
图2所示。代谢机制普遍,厌氧“教科书”原生生物(如阴道毛滴虫)氢化酶体(“II型厌氧生物”;穆勒于1993年,1998年)。丙酮酸形成细胞质中由糖酵解(C),导入到氢化酶体(H)和代谢醋酸形成H2和CO2。ATP是由底物水平磷酸化的酶醋酸琥珀酰辅酶转移酶(ASCT 2)和琥珀酸thiokinase (STK、3)。ATP由ADP-ATP出口载体(AAC J)。电子产生的丙酮酸的氧化脱酸是由丙酮酸转移到铁氧还蛋白:铁氧还蛋白氧化还原酶(卵圆孔未闭,1)和质子的Fe-hydrogenase(海德拉巴,4)。N:细胞核。从Hackstein et al。(2001),修改
在最初的检查,除了双膜,这些细胞器,线粒体形态和生化反应,有别于(图4;Benchimol et al . 1996;Benchimol和Engelke
2003)。后续的生化和分子研究改变了这一观点,尽管有时在一种一厢情愿的想法。滴虫氢化酶体拥有mitochondrial-like chaperonins, HSP 10, HSP 60和HSP 70(克拉克和罗杰1995;Bui et al . 1996;Germot et al . 1996),线粒体载体家族的蛋白质(HMP 31;看到Dyall et al . 2000, 2004;Tjaden et al。
2004)。许多hydrogenosomal蛋白质的氨基端扩展支持的假设mitochondrial-type进口机械将促进
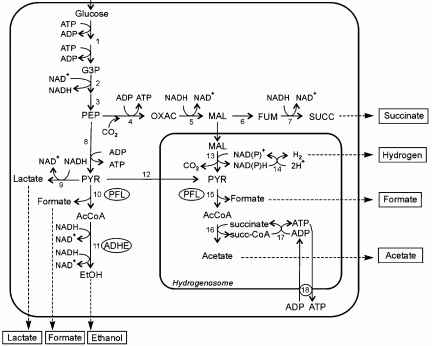
图3所示。能量代谢的厌氧真菌chytridiomycete Piromyces sp, E2。的面板显示了方案中涉及的代谢途径主要终端产品的生产,这是代表bacterial-type混合酸发酵。在面板的数字显示以下酶:(1)己糖激酶,glu-cose-6-phosphate异构酶、磷酸果糖激酶1,醛缩酶和磷酸丙糖异构酶;(2)甘油醛3-phosphosphate脱氢酶;(3)磷酸甘油酸酯激酶、磷酸甘油酸酯变位酶和烯醇酶;(4)磷酸烯醇丙酮酸car-boxykinase;(5)苹果酸脱氢酶;(6)延胡索酸酶;(7)延胡索酸盐还原酶; (8) pyruvate kinase; (9) lactate dehydrogenase; (10) cytosolic pyruvate:formate lyase; (11) alcohol dehydrogenase E; (12) pyruvate import into hydrogenosomes; (13) malic enzyme; (14) hydrogenase; (15) hydrogenosomal pyruvate: formate lyase; (16) ace-tate:succinate CoA-transferase; (17) succinyl-CoA synthethase; (18) ADP/ATP carrier. Abbreviations; AcCoA acetyl-CoA; EtOH ethanol; FUM fumarate; G3P glyceralde-hyde-3-phosphate; MAL malate; OXAC oxaloacetate; PEP phosphoenolpyruvate; PYR pyruvate; SUCC succinate. An analysis of the metabolic fluxes revealed that the formation of hydrogen via the malate route can become marginal under certain culture conditions (Boxma et al. 2004). From Boxma et al. (2004), modified.
进口nuclear-encoded hydrogenosomal蛋白质到细胞器(Dyall和约翰逊2000;Dyall et al . 2000, 2004;Embley et al . 2003年)。同时,琥珀酸酯的存在:CoA-transferase活动(穆勒1993,1998;范Hellemond et al . 1998年),一种酶的活动,由这些细胞器共享
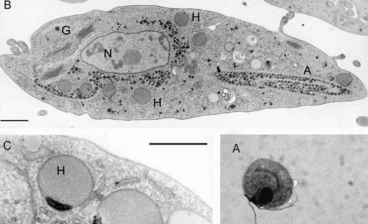
图4所示。阴道毛滴虫,光eosin-stained细胞的显微照片;自然大小大约10 x 45 | m(由h . Aspock维也纳)。B Tritrichomonas胎儿的电子显微照片:7氢化酶体(H)可以确定在细胞质中(N核;G高尔基体;axostyl)。C更高放大显示,双膜围绕氢化酶体。边际板(M)。B和C都请提供的m . Benchimol里约热内卢酒吧。在B和C 1 | m。 From Hackstein et al. (2001), modified.
图4所示。阴道毛滴虫,光eosin-stained细胞的显微照片;自然大小大约10 x 45 | m(由h . Aspock维也纳)。B Tritrichomonas胎儿的电子显微照片:7氢化酶体(H)可以确定在细胞质中(N核;G高尔基体;axostyl)。C更高放大显示,双膜围绕氢化酶体。边际板(M)。B和C都请提供的m . Benchimol里约热内卢酒吧。在B和C 1 | m。 From Hackstein et al. (2001), modified.
和某些线粒体,似乎表明“线粒体”祖先的氢化酶体滴虫(穆勒1993,1998;Dyall和约翰逊2000;生搬硬套et al . 2000年)。然而,滴虫氢化酶体明显不同于线粒体,因为他们缺乏一个基因组,核糖体,细胞色素,电子传递链,心磷脂,嵴(穆勒1993,1998;Benchimol et al . 1996;克莱门斯和约翰逊2000;Voncken et al . 2002;Benchimol和Engelke 2003)。此外,他们的进口机械似乎表现出相当特别的特征并不与线粒体(2004年Dyall et al . 2003年)。像线粒体,他们进口丙酮酸,糖酵解的结果,但是滴虫氢化酶体不使用丙酮酸脱氢酶(PDH)丙酮酸的分解代谢。 Rather, these hydrogenosomes metabolize pyruvate through pyruvate .ferredoxin oxidoreductase (PFO) and hydrogenase to acetate, carbon dioxide and hydrogen (Fig. 2; Müller 1993, 1998). Acetate formation from acetyl-CoA is believed to be coupled to the substrate level phosphorylation of succinate via the enzyme acetate.succinate CoA transferase (ASCT; Müller 1993); this route should yield 1 ATP per mol of pyruvate consumed. ASCT is one of the few enzymes, which are known to be shared between hydrogenosomes and certain mitochondria. However, it is still unknown whether or not the genes encoding proteins with ASCT activity are the same in trichomonads and ki-netoplastids (cf. Riviere et al. 2004). Additional ATP formation seems to be feasible by the generation of a PMF as in mitochondria (Humphreys et al.
1998)。一代及尚未研究的细节,但是一个质子梯度的一代滴虫氢化酶体很可能(特纳和Lushbaugh 1991)。值得注意的是,潜在的毛滴虫F1F0 ATP合成酶尚未确认到目前为止,和滴虫氢化酶体可以作为细胞的观察Ca2 +商店(Biagini et al . 1997年)与尊重,而间接的“线粒体”血统。然而,它可能会得出结论,滴虫氢化酶体能够生成及H +和/或一个梯度,尽管mitochondrial-like电子传递链缺席(汉弗莱斯et al . 1998年)。因此,毛滴虫hydrogeno-somes之间的关系和aerobically-functioning线粒体明显低于建议在许多出版物(见下文)。
厌氧纤毛虫的氢化酶体:至少有一个似乎是线粒体产生氢气
纤毛虫属于真核生物的“皇冠集团”1991)(·索金说,和至少8的22个订单分类的纤毛虫的威廉姆森(1979),厌氧物种进化(Fenchel和芬利1995)。有一定的协议,厌氧纤毛虫其次从有氧的祖先进化而来的一些更高的纤毛虫类群组成有氧和厌氧物种(Embley et al . 1995、1997、2003;Fenchel和芬利1995;Hackstein et al . 2001, 2002)。善意的氢化酶体存在于7的22个订单,但证据表明这些氢化酶体独立进化,不断从线粒体,而间接的。值得注意的是,Akhmanova et al。(1998)和van Hoek et al。(2000)提出了直接证据的存在线粒体基因组的氢化酶体Nyctotherus卵厌氧,heterotrichous纤毛虫,居住在蟑螂的肠道(Gijzen et al . 1991;Akhmanova et al . 1998;范Hoek et al。1998、1999、2000 b)。这个基因组,通过免疫细胞化学、主机核糖体rna基因大量表达,和系统发育分析揭示了一个聚类中线粒体核糖体rna基因的有氧纤毛虫(van Hoek et al . 2000;Hackstein et al . 2001年)。 Since the phylogenies of the nuclear 18S rRNA genes of the ciliates are congruent with the SSU rRNA genes of their mitochondria and hydrogenosomes (Akhmanova et al. 1998a; van Hoek et al. 1998, 2000a,b; Hackstein et al. 2001), it is likely that the hydrogenosomes of N. ovalis evolved from the mitochondria of aerobic ciliates. Moreover, the hydrogenosomes of N. ovalis possess cristae, and thus morphologically resemble mitochondria (Fig. 5; Akhmanova et al. 1998a; Hackstein et al. 2001). In addition, there is evidence for quite a number of genes encoding mitochondrial proteins (located on the macronuclear or organelle genome, respectively (Boxma et al. 2005). Therefore, it seems reasonable to assume that the hydrogenosomes of heterotrichous ciliates evolved from mitochondria that adapted to anaerobic environments. There is evidence that the hydrogenosomes of rumen ciliates and plagiopylid ciliates, too, evolved from mitochondria (Embley et al. 1995). However, these hydrogenosomes are quite different from those of N. ovalis and it is likely that they evolved independently (see below).
Akhmanova et al。(1998)表明,纤毛虫的氢化酶体具有一个(Fe)氢化酶编码的macronuclear gene-sized染色体。这个“氢化酶”代表一种小说(Fe)氢化酶,允许直接耦合H2-formation NADH的再氧化。(Fe)氢化酶与蛋白质共价有关,具有NAD和FMN结合位点,ferredoxin-like模块允许电子转移氢化酶的催化部位(Akhmanova et al . 1998;Vignais et al . 2001;Voncken et al . 2002 b)。hydro-genase的起源(s)的重要性不仅对氢的假说,而且对理解各种类型的hydrogeno-somes的进化。所有真核(Fe)氢化酶,包括hydrogenase-like蛋白质(“NARFs cf。犹豫et al . 2004年),无论是生产还是消费氢,似乎形成了一个单源集群,可能排除卵圆n氢化酶(Akhmanova et al . 1998;霍纳et al . 2000, 2002;尼克松et al . 2003年)。然而,由于氢化酶的高保护
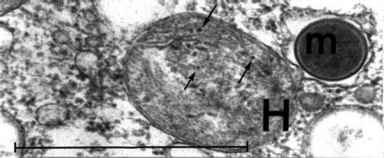
图5所示。氢化酶体(H) Nyctotherus卵在较高放大看起来像一个线粒体(戊二醛/ OsO4固定)。内和外膜,crista-like内陷的内膜(箭头),和70年代的ri-bosomes可以确定(箭头)。米产甲烷内共生体。酒吧1 | m。(从Akhmanova et al . 1998,修改)
图5所示。氢化酶体(H) Nyctotherus卵在较高放大看起来像一个线粒体(戊二醛/ OsO4固定)。内和外膜,crista-like内陷的内膜(箭头),和70年代的ri-bosomes可以确定(箭头)。米产甲烷内共生体。酒吧1 | m。(从Akhmanova et al . 1998,修改)
和敏感性物种抽样,统计支持这两种的发展史很差(Voncken et al . 2002 b;Embley et al . 2003年)。即使识别第一proteobacterial氢化酶系统难题无法解决(戴维森et al . 2002;Embley et al . 2003年)。最近隔离氢化酶的基因编码的瘤胃纤毛虫(Boxma 2004)支持常见的真核所有真核氢化酶和NARFs起源——除了n .卵的氢化酶,这似乎是一个马赛克的蛋白质8 proteobacterial和P proteobacterial起源(Akhmanova et al . 1998;霍纳et al . 2000, 2002;Voncken et al . 2002 b)。(Fe) -hydrogenases瘤胃纤毛虫和厌氧壶显然属于真核集群。他们是类似于“长形”(Fe)氢化酶从毛滴虫。有趣的是,系统发育分析厌氧氢化酶的壶集群与绿藻的极短的氢化酶,在plastidic函数而不是在线粒体电子传递(弗罗林et al . 2001; Horner et al. 2002; Voncken et al. 2002b; Nixon et al. 2003). However, the origin of these eu-karyotic hydrogenases from a hypothetical hydrogenase-containing universal endosymbiont remains unclear; in particular, there is no statistical support for the assumption that all eukaryotic hydrogenases (including the NARFs) evolved from an a-proteobacterial ancestor (Horner et al. 2002; Voncken et al. 2002b; Embley et al. 2003; Stejskal et al. 2003).
氢化酶体厌氧壶:另一种方式来适应厌氧环境
厌氧壶是重要的在许多食草哺乳动物的胃肠道共生体。他们的生命周期由一个交变鞭毛的游动孢子阶段和一个营养阶段multi-nucleated菌丝体时形成的。的菌丝rhizomycelial系统附着在digesta和分泌一种广谱fibrolytic非常有效的酶消化植物聚合物(Teunissen et al . 1991;景天1994;Yarlett 1994)。这些生物是高度适应肠道环境;他们的最佳生长温度恰逢哺乳动物宿主的体温,几乎在整个生命周期中,他们生活和繁殖缺氧条件下(景天1994)。厌氧壶从mitochondria-bearing祖先进化而来,因为DNA序列分析揭示了一个集群有氧和厌氧壶(鲍曼et al . 1992;cf。帕奎因et al . 1995;帕奎因和朗1996)。生化和形态特征的分析建立了一个壶之间密切的关系和其他真菌(Ragan和查普曼1978年),和Akhmanova et al。(1998 b)表明,线粒体起源的几种酶,缺乏公认的目标信号,被gdp8 %的细胞质(活动形式)不再出现在氢化酶体。因此,毫无疑问,壶生活在食草哺乳动物的胃肠道其次采用厌氧生活方式(Hackstein et al . 1999年)。
厌氧壶等,例如Neocallimastix Piromyces拥有氢化酶体,,然而,在结构上和功能上明显不同的氢化酶体纤毛虫n .卵的amoe-boflagellate Psalteriomonas lanterna和parabasalid t .鞘突(图6;库姆斯和Hackstein 1995;Hackstein et al . 1999, 2001)。的氢化酶体amoeboflagellate p lanterna (Hackstein unpubl。)和parabasalid t .鞘突(克莱门斯和约翰逊2000)Neocallimastix和Piromyces缺乏一个基因组的氢化酶体(van der Giezen et al . 1997;Hackstein, unpubl)。但与t .养狐场氢化酶体,壶氢化酶体依赖苹果酸和不是氢形成丙酮酸。由hydrogenosomal苹果的进口苹果酸氧化脱羧酶,它被认为由丙酮酸生成的丙酮酸氧化进一步:铁氧还蛋白氧化还原酶(卵圆孔未闭)乙酰辅酶a。减少等价物应该通过铁氧还蛋白转移氢化酶从而维护氧化还原平衡(Marvin-Sikkema et al . 1992、1993、1994)。然而,Akhmanova et al。(1999)和Boxma et al。(2004)表明,厌氧壶的氢化酶体执行bacterial-type混合酸发酵中丙酮酸分为乙酰辅酶a和甲酸pyru-vate:甲酸裂解酶(PFL),而不是氧化脱羧的卵圆孔未闭。因此,减少避免同类的形成,这种hydro-genosome排泄甲酸和乙酸作为其能量代谢的终端产品(图3)。此外,绝大多数的碳流过氢化酶体是由丙酮酸,这是进口cyto-sol无氢的氢化酶体代谢形成(Boxma et al . 2004年)。 Obviously, the hydrogenosomes of anaerobic chytrids followed a different strategy when adapting to anaerobic environments: avoiding the formation of reduced equivalents renders hydrogen production a rudimentary metabolic activity in these organelles.
ADP / ATP的功能和系统发育分析运营商从厌氧壶氢化酶体明显支持这些细胞器的真菌线粒体起源(van der Giezen et al . 2002;Voncken et al . 2002;Tjaden et al . 2004年)。鉴于壶氢化酶体缺乏一个基因组,ADP / ATP运营商和HSP 60的“次佳”标记跟踪这些细胞器的进化历史(安德森和Kurland 1999)。两个基因的系统发育分析明确揭示一种真菌线粒体祖先(Hackstein et al . 1999;Voncken 2001;van der Giezen et al . 2002, 2003;Voncken et al . 2002年),在协议与早些时候发现典型的线粒体酶被gdp8 %细胞质壶的演变过程中氢化酶体(Akhmanova et al . 1998 b)。
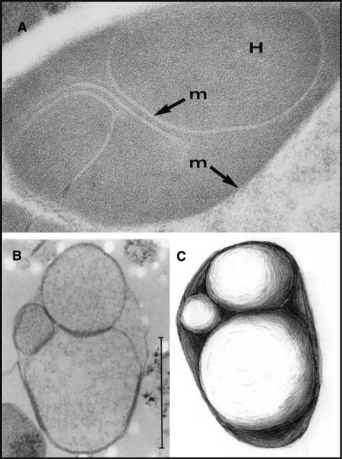
图6所示。氢化酶体的电子显微照片的厌氧壶Neocallimastix sp。L2,孤立的从骆驼的粪便。这种类型的氢化酶体的形态非常不同于滴虫sp.或Nyctotherus卵。箭头指示的膜(m)和囊泡。从Hackstein et al . 2001年,修改。B部分通过氢化酶体Neocallimastix进行渗透处理(低渗的)。“豌豆荚”组织的氢化酶体变得可见。酒吧| 0.5米。C艺术家的细胞器b所示的视图Voncken et al .(2002),修改
图6所示。氢化酶体的电子显微照片的厌氧壶Neocallimastix sp。L2,孤立的从骆驼的粪便。这种类型的氢化酶体的形态非常不同于滴虫sp.或Nyctotherus卵。箭头指示的膜(m)和囊泡。从Hackstein et al . 2001年,修改。B部分通过氢化酶体Neocallimastix进行渗透处理(低渗的)。“豌豆荚”组织的氢化酶体变得可见。酒吧| 0.5米。C艺术家的细胞器b所示的视图Voncken et al .(2002),修改
壶氢化酶体因此分明从毛滴虫的氢化酶体形成的基础Martin-Muller氢假说的真核细胞的演变。细胞器的起源即。,宇宙内共生体滴虫和有区别的真菌线粒体的厌氧壶,和适应进化策略缺氧的环境是不同的。由于滴虫的氢化酶体基因组(克莱门斯和缺乏
约翰逊2000),分析hydrogenosomal ADP / ATP的航空公司应该提供的线索对氢或假设。令人惊讶的是,滴虫氢化酶体没有主机类型线粒体ADP / ATP运营商(Tjaden et al . 2004年)。而是使用不同的线粒体载体家族的成员,hydrogenosomal膜蛋白(HMP 31)对ADP / ATP交换功能和系统有别于mitochon-drial-type ADP / ATP运营商(Dyall et al . 2000;Tjaden et al . 2004年)。基因编码HMP 31个分支比mitochondrial-type ADP / ATP运营商,来源于hydrogen-hypothesis预测的一致,和偏离hydrogenosomal进口机械讨论Dyall et al . (2003、2004)。还值得注意的是,HSP 60的发展史集群滴虫HSP (cpn) 60基因“amitochondriate”(但mitochondrial-remnant-bearing)类群(diplomonads entamoebids)而不是“真正的”线粒体chap-eronines (Voncken 2001;Voncken et al . 2002;van der Giezen et al . 2003年)。
继续阅读:点头的因素
这篇文章有用吗?