苔藓植物共生实验系统
本章将回顾主要利用固氮蓝藻Nostoc punctiforme(菌株PCC 73102,同名ATCC 29133)和苔藓植物角苔Anthoceros punctatus(在实验室中与单独纯培养的伙伴进行常规重组)之间的联系的研究结果。重点将更多地放在相互作用的机制上,而不是共生体的多样性;后者是一个不断扩大的主题,最近已使用分子遗传技术进行了研究(West和Adams 1997;Costa等,2001;Rasmussen和Nilsson 2002)。现已知N. punctiforme菌株ATCC 29133的完整基因组序列(http://genome.jgi-psf.org/microbial/).因此,将在N. punctiforme基因组序列的背景下讨论结果和概念,并提出假设,以及两个伙伴的遗传、生理和生化特征。适当时,还将与其他蓝藻细菌进行比较植物系统.
点状诺具有非常广泛的生理特性、营养细胞发育选择和生态位(Meeks et al. 2002;米克斯2003)。它可以通过基因操作,包括随机转座子诱变(Cohen et al. 1994)和靶向基因替换(Hagen and Meeks 1999)。这些集体特征增强了其基因组序列的科学价值(Meeks et al. 2001)。N. punctiforme是蓝藻的一个亚群,可以在完全黑暗的环境中作为呼吸异养体生长,这种代谢模式可能是共生关系所必需的。其中两个发展选择对其共生相互作用至关重要;运动细丝的分化称为hormogonia,它们是植物结合体的感染单位,也是杂囊的感染单位固氮酶在几乎所有的Nostoc菌株中表达(图1)。第三种营养细胞发育选择是被称为akinetes的静息细胞的形成。Akinetes可以在植物的衰老区域被检测到,但它们在共生相互作用中的作用,如果有的话,还没有被解决。包括营养细胞周期在内,针状N. N.营养细胞的四个发育方向在细菌世界中在数量上是无可比拟的。它们为细胞周期的发育调节提供了多个阶段,包括来自共生伙伴的环境信号。N. punctiforme基因组包含大量的感觉转导系统,大约有156个传感器组氨酸激酶,103个反应调节蛋白,51个丝氨酸/苏氨酸蛋白激酶,加上7个推测的腺苷酸/鸟苷酸环化酶(Meeks et al. 2001;米克斯2005)。调节这些感觉系统活动的环境信号在很大程度上是未知的;然而,有超过充足的调节蛋白作为共生伙伴信号的潜在目标。
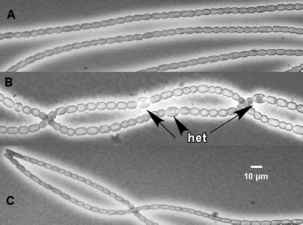
图1所示。三种自由生活发育状态的相位对比显微照片。A缺乏任何分化细胞的铵生长的细丝。含有固氮杂囊(het)的双氮生长丝状物呈非随机间距分布。C能动的连锁体与N2或NH4+培养物相比,丝状细胞尺寸较小。面板A和C摘自Meeks等人(2002)
图1所示。三种自由生活发育状态的相位对比显微照片。A缺乏任何分化细胞的铵生长的细丝。含有固氮杂囊(het)的双氮生长丝状物呈非随机间距分布。运动激素丝显示相对于N2或NH4+培养的细胞尺寸更小。面板A和C摘自Meeks等人(2002)
Nostoc punctiforme在植物系统发育谱中显示出广泛的共生能力,包括苔藓植物角苔(Enderlin和Meeks 1983)和地苔(Joseph和Adams 2000),裸子苏铁,从那里分离出来(Rippka等人1979),被子植物Gunnera spp. (Johansson和Bergman 1994),以及非地衣真菌G. pyriforme (Kluge等人2002)。图2展示了植物群落的照片,说明了蓝藻所处的不同区域。很难想象N. punctiforme在进化过程中,随着群体成员的出现,为每个植物类群相继发展出特定的适应过程。相反,合理的假设是,植物必须有独立进化的策略来控制蓝藻的关键调节和代谢途径,这些途径通常在自由生长中表达。例如,碳和能量代谢向异养模式的转变,激素和杂囊的分化,以及N2固定是Nostoc在没有植物伙伴的情况下表达的基本过程,但当植物伙伴在场时,反应会增强(Meeks 1998)。因此,Nostoc从自由生长到共生生长的转变可以最好地描述为响应程度的变化。相反,当根瘤菌与豆科植物结合时,营养细胞转变为类细菌状态,并诱导固氮酶的合成和活性,它们在植物伙伴之外都不表达(van Rhijn和Vanderleyden)
1995)。这些向根瘤菌共生生长状态的形态和生理转变是一种新的反应。此外,Nostoc在植物的结构或区域(称为共生腔)中殖民,这些结构或区域一直存在,在共生状态下变化很小。相反,根瘤菌诱导根结节的形成,根结节可以被认为是一种新的植物器官,其结构可以保护固氮酶免受氧气的影响,同时为根瘤菌的呼吸提供足够的氧气(van Rhijn和Vanderleyden 1995)。事实上,Nostoc和相关的杂囊形成物种携带自己的氧气保护机制,可能解释了它们的共生关系相对简单。这些程度上的差异,相对于反应的种类,简单的结构,相对于一个新的器官,有助于我们的结论,在以nostoc为基础的共生中,相互作用主要(但不完全)是单向的,从植物到蓝藻(Meeks 1998),相比之下,伙伴之间广泛的信号交换是根瘤菌-豆科植物关联的特征(Perret et al. 2000)。
苏铁属裸子植物
苏铁属裸子植物
-

- 苔藓植物,homwort, Anthoceros,被子植物,Gunnera

图2所示。刺状芽孢杆菌将与之形成共生关系的三种陆地植物伙伴的代表照片。裸子植物苏铁(Cycas sp.),显示营养叶(A)和(B)一个切除的珊瑚状根,其中一个叶的尖端被剖开以显示环形蓝藻腔(nc)。A板和B板的横条长度分别为0.5 m和0.5 cm。在C和D图中,苔藓植物角苔Antho-ceros punctatus的纯培养配子体组织在实验室重建,其中N. punctiformme定位于黏液腔(nc)。C、D面板的横条均为1.0 cm。被子植物Gunnera sp .描绘了具有独特茎腺的幼苗(E) Nostoc进入茎的位置和(F)巨大的Gunnera chilensis植物茎的切线部分,显示Nostoc占据了许多共生腔(nc)。E和F面板的横条均为1.0 cm。摘自Meeks and Elhai (2002)
图2所示。刺状芽孢杆菌将与之形成共生关系的三种陆地植物伙伴的代表照片。裸子植物苏铁(Cycas sp.),显示营养叶(A)和(B)一个切除的珊瑚状根,其中一个叶的尖端被剖开以显示环形蓝藻腔(nc)。A板和B板的横条长度分别为0.5 m和0.5 cm。在C和D图中,苔藓植物角苔Antho-ceros punctatus的纯培养配子体组织在实验室重建,其中N. punctiformme定位于黏液腔(nc)。C、D面板的横条均为1.0 cm。被子植物Gunnera sp .描绘了具有独特茎腺的幼苗(E) Nostoc进入茎的位置和(F)巨大的Gunnera chilensis植物茎的切线部分,显示Nostoc占据了许多共生腔(nc)。E和F面板的横条均为1.0 cm。摘自Meeks and Elhai (2002)
共生一词最初是由deBary(1879)定义的,它简单地描述了不同命名的生物共同生活。它现在最常应用于互惠互动,在这种亲密的身体联系中,所有参与的生物都明显受益,而不是寄生互动,一方受益,另一方慢慢受到伤害。互惠性术语可能恰当地反映了根瘤菌与豆科植物的关联,其中异养根瘤菌受益于光自养植物的物理关联,而植物受益于细菌的固氮活性。与光自养植物相结合的光自养植物的好处并不明显,除了,也许,作为一个庇护所,以避免放牧捕食。作为互惠和寄生的替代,我们将固氮Nostoc结合描述为一种共生形式,更准确地说,是蓝藻氨生产工厂(共生)的植物驯化(Meeks和Elhai 2002)。蓝藻既不会从这种关联中获益,也不会受到伤害。因此,我们正在测试的工作模型没有得出与根瘤菌结瘤相似的调控或结构基因(点头)基因仅在细菌与豆科植物结合时才活跃(van Rhijn和Vanderleyden 1995;Perret et al. 2000),尽管一般策略和化学信号可能相似。
上述共生相互作用中信息单向流动的概念导致了这样一种假设,即这些固氮关联中的调节回路和结构基因靶点是蓝藻谱系中唯一进化的。我们在植物性发育替代的背景下提出了类似的进化场景(Meeks et al. 2002;米克斯2005)。因此,编码这些过程的基因不能通过纯粹的比较生物信息学方法在基因组序列中识别出来。相反,从基因组中提取相应基因的功能分析是必要的。
作为设计功能分析的指导,我们开发了工作模型。点状芽孢杆菌和点状芽孢杆菌之间的相互作用,虽然很可能是一个连续体,但在实验上可以分为两个连续阶段,每个阶段都有子阶段(图3)。初始阶段是建立联系,涉及感染单位激素丝的分化和行为。第二阶段是功能关联的发展,包括营养细胞的生长和代谢改变,以及杂囊的分化和行为。我们从N. punctiformme中分离出的突变体支持这个模型,这些突变体在关联的建立或功能发展方面分别存在缺陷(表1)。突变基因产物的生理作用将在后续章节中讨论。
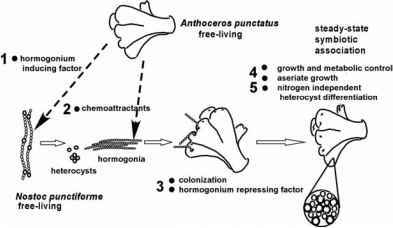
图3所示。点状虫和N.点状虫之间相互作用的连续体示意图,导致n2固定共生关系。从植物到蓝藻的相互作用被描述为单向的。这些数字指的是实验中不同的子阶段,在文本中描述。转载自Meeks (2003)
图3所示。点状虫和N.点状虫之间相互作用的连续体示意图,导致n2固定共生关系。从植物到蓝藻的相互作用被描述为单向的。这些数字指的是实验中不同的子阶段,在文本中描述。转载自Meeks (2003)
应变 |
共生 |
乙炔 |
基因 |
阶段 |
|
coloniesa |
reductionb |
诱导 |
影响 |
||
byc |
|||||
每g FW |
殖民地 |
||||
写明ATCC 29133 d |
0.21±0.04 |
6.3±1.2 |
12.4±3.3 |
-- |
-- |
ucd398(叹息)d |
1.2±0.2 |
8.0±3.9 |
10.1±4.1 |
低氧诱导因子 |
感染 |
UCD 328 (hrmAf |
1.6±0.1 |
6.1±1.1 |
8.6±1.3 |
HRF |
感染 |
UCD 444 (ntcA) f |
0 |
0 |
0 |
-- |
感染 |
ucd416 (hetF) |
0.26±0.06 |
0 |
-- |
函数 |
|
UCD 464 (her)f |
0.36±0.04 |
0 |
0 |
-- |
函数 |
共培养2周后,在解剖显微镜下可见的共生菌落数量,归一化为计数的点状棘球蚴组织的mg干重量和Nostoc接种剂的|g Chl a
原位乙炔还原活性以每克新鲜重量配子体组织形成的nmol乙烯或以每共生Nostoc菌落形成的pmol乙烯表示
cHIF是激素诱导因子(hormogonium induction factor),是指含诱导激素分化因子的点状棘球蚴(a . punctatus)分泌物;HRF是激素抑制因子,指的是含有抑制激素分化因子的马点蒿水提取物”Campbell et al. (1998) eCohen and Meeks (1996) fWong and Meeks (2002)
共培养2周后,在解剖显微镜下可见的共生菌落数量,归一化为计数的点状棘球蚴组织的mg干重量和Nostoc接种剂的|g Chl a
原位乙炔还原活性以每克新鲜重量配子体组织形成的nmol乙烯或以每共生Nostoc菌落形成的pmol乙烯表示
cHIF是激素诱导因子(hormogonium induction factor),是指含诱导激素分化因子的点状棘球蚴(a . punctatus)分泌物;HRF是激素抑制因子,指的是含有抑制激素分化因子的马点蒿水提取物”Campbell et al. (1998) eCohen and Meeks (1996) fWong and Meeks (2002)
继续阅读:性腺虫的关联、分化和行为的建立
这篇文章有用吗?
读者的问题
-
Aziza一年前
- 回复
