橄榄石碳酸
矿物碳酸化作用
7.2.1定义、系统边界和动机
矿物碳酸化是基于二氧化碳与含金属氧化物物质反应形成不溶性碳酸盐,其中钙和镁是最具吸引力的金属。在自然界中,这种反应被称为硅酸盐风化发生在地质时间尺度上。它涉及天然硅酸盐作为碱性和碱土金属的来源,并消耗大气中的二氧化碳。然而,本章讨论的是所谓的矿物碳酸化,即从捕集步骤(见第3章)中获得的高浓度CO2与金属氧化物材料接触,目的是将CO2固定为碳酸盐(Seifritz, 1990;Dunsmore, 1992;Lackner et al., 1995)。合适的材料可能很丰富硅酸盐岩石,蛇纹石和橄榄石例如矿物,或规模较小的碱性工业残留物,如钢铁生产的炉渣或飞灰。对于硅酸盐岩石,也可以进行碳酸化让其它在化学加工厂开采和预处理硅酸盐后,或者在富硅酸盐中注入二氧化碳地质结构或者在碱性含水层中。另一方面,工业残留物可以在生产它们的同一工厂进行碳酸化。值得注意的是,为地质储存注入的CO2与盖层中的碱性或碱土金属反应导致“矿物圈闭”(见第5.2.2章),其原位矿物碳酸化和地质储存的产物可能相似。
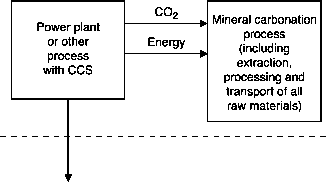
在物质和能量平衡方面,矿物碳酸化可概括为图7.1所示,适用于a电厂通过矿物碳酸化来捕获和储存二氧化碳。对于具有捕集和地质或海洋储存(见图1.4)的发电厂的同一方案,可以观察到两个差异。首先,存在与所述金属氧化物承载材料相对应的附加材料通量;它以碳酸盐、二氧化硅、非反应矿物和某些输入矿物产品水的形式存在,作为输入和输出。其次,对于相同的可用能量输出,相对的数量化石燃料作为输入的能量和作为低品位热而被拒绝的能量是不同的。原位碳酸化是一种类似于地质储存的操作,而非原位碳酸化涉及需要额外能量输入的处理步骤,难以用碳酸化反应释放的能量来补偿。鉴于原位碳酸作用与地质储存的相似之处,本章将重点讨论非原位矿物碳酸作用。以目前的技术,总有对高品位能源的净需求,以驱动矿物碳酸化过程,需要:(i)固体反应物的制备,包括采矿、运输、研磨和必要时的活化;(ii)处理过程,包括与使用有关的等效能量;回收添加剂和催化剂的可能损失;(iii)碳酸盐及其副产品的处置。这三种物质的相对重要性取决于金属氧化物的来源,例如它们是天然硅酸盐还是天然硅酸盐工业废物.
尽管存在这种潜在的能量损失,但人们对矿物碳酸化的兴趣源于两个特点,这两个特点使其在不同的储存方法中是独一无二的,即含金属氧化物材料的丰度,特别是天然硅酸盐,以及二氧化碳以稳定的固体形式储存的持久性。然而,
化石燃料
其他材料
储存的二氧化碳(碳酸盐)
二氧化碳排放
其他排放物和污水
产品(年代)
图7.1通过矿物碳酸化捕获和储存二氧化碳的发电厂通过系统边界的材料和能量平衡。化石燃料的输入既为产生二氧化碳的发电厂提供能量,也为矿化过程提供能量(直接或间接地通过发电厂)。“其他材料”输入服务于系统边界内的所有过程,包括用于矿化的金属氧化物材料。“其他排放”由矿化反应的副产物——二氧化硅和可能的水——以及未反应的输入物质组成。
-
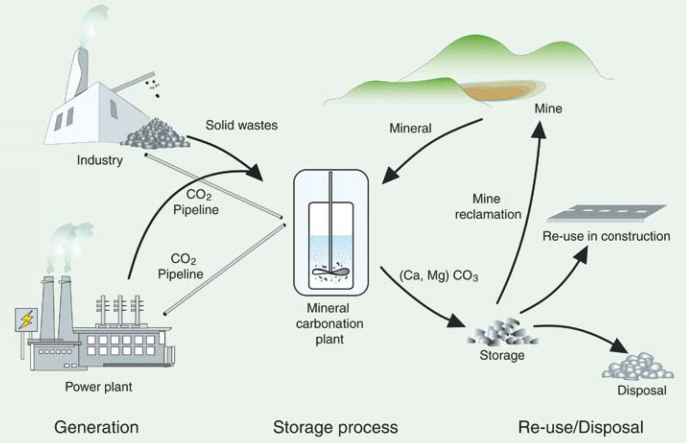
- 图7.2与硅酸盐岩石或工业残留物的迁地矿物碳酸化有关的物质通量和工艺步骤(荷兰能源研究中心提供)。
矿物碳酸化在今天仍然是一项不成熟的技术。文献中报道的研究还没有达到对技术、潜力、成本和影响进行全面评估的水平。
7.2.2矿物碳酸化化学
当CO2与金属氧化物(这里表示为MO,其中M为二价金属,如钙、镁或铁)反应时,相应的碳酸盐形成,并根据以下化学反应释放热量:
橄榄石:
Mg2SiO4 + 2CO2 ^ 2MgCO3 + SiO2
蛇:
Mg3Si2O5(OH)4 + 3co2 ^ 3MgCO3 + 2SiO2 + 2H2O
热量取决于特定的金属和含有金属氧化物的材料。一般来说,这是一个很大的比例(在氧化钙的情况下高达46%)释放热量上游燃烧形成CO2(元素碳燃烧393.8 kJ mol-1CO2)。在一些天然硅酸盐的情况下,发生以下放热化学反应(在所有情况下,热值为每单位摩尔CO2和标准条件25°C和0.1 MPa,罗比等,1978年):
硅灰石:
^ CaCO3 + SiO2 + 90 kJ mol-1CO2 (2c)
由于反应释放热量,在低温下有利于碳酸盐的生成,而在高温下(碳酸钙高于900℃,碳酸镁高于300℃,CO2分压为一巴),则有利于反向反应,即煅烧。上述第一反应中所考虑的橄榄石家族的代表成员是无铁的橄榄石。在自然界中,大多数橄榄石含有一些铁,可以形成氧化铁或菱铁矿(FeCO3)。
即使在大气CO2的低分压和环境温度下,含金属氧化物矿物的碳酸化也会自发发生,尽管是在地质时间尺度上(Robie etal ., 1978;Lasaga和Berner, 1998)。限制来自于碳酸化过程中矿物表面形成的二氧化硅或碳酸盐层,这往往会阻碍进一步的反应和限制转化(Butt等人,1996年),以及在水反应的情况下,从气相吸收CO2的速率。矿物碳酸化面临的挑战是找到加速碳酸化的方法,并在环境限制下利用反应热,例如以最小的能源和材料损失。
7.2.3金属氧化物的来源
大多数正在考虑的矿物碳酸化工艺都集中在含有碱土金属(如钙和镁)的金属氧化物材料上,而不是碱金属(如钠和钾),其相应的碳酸盐非常易溶于水。钙和镁的氧化物和氢氧化物将是理想的原料,但由于它们的反应性,它们在自然界中也是极其罕见的。因此,合适的含金属氧化物矿物可能是硅酸盐岩石或碱性工业残渣,前者丰富但一般难以获得,后者稀少但容易获得。
在硅酸盐岩石中,镁铁质和超镁铁质岩石是含有大量镁、钙和铁,钠和钾含量低的岩石。它们的主要矿物成分有橄榄石、蛇纹石、顽辉石(MgSiO3)、滑石(Mg3Si4O10(OH)2)和硅灰石。虽然地壳中镁和硅酸钙的摩尔丰度相似,但含有硅酸镁的岩石表现出更高的MgO浓度(按重量计算可达50%,对应于0.55 kg CO2/kg岩石的理论CO2存储容量),而含有硅酸钙的岩石,例如玄武岩,其CaO含量仅为重量的10%左右(理论CO2存储容量为0.08 kg CO2/kg岩石)(Goff和Lackner, 1998年)。硅灰石是最富钙的硅酸盐,它的矿床比富含镁的硅酸盐稀少得多。
蛇纹石和橄榄石主要见于蛇绿岩带——碰撞的地质带大陆板块导致地壳抬升(Coleman 1977)。例如,考虑到美国东部和波多黎各含有蛇纹石和橄榄石的超镁铁质矿床,发现它们的RCO2值在1.97到2.51之间,这取决于纯度和类型(RCO2是假设矿物在碳酸化后完全转化时所需的矿物质量与固定的二氧化碳质量的比率,即上述理论二氧化碳储存容量的倒数)。橄榄岩和蛇纹岩超过了中和全球所有煤炭资源产生的二氧化碳所需的总镁量,估计为10,000 Gt (Lackner et al., 1995)。在美国和波多黎各的两项研究中确定的特定矿床增加到大约300GtC02 (Goff和Lackner, 1998;Goff et al, 2000)。与之相比,美国的二氧化碳排放量约为5.5 GtC02,全球约为24 GtC02/年。目前还没有关于蛇绿岩带全球储量潜力的全面测绘报告。然而,它们的总表面暴露估计为1000公里× 100公里(Goff等,2000年)。然而,众所周知,硅酸镁储量存在于所有大陆,但由于它们倾向于遵循现在或古代大陆边界但并非所有国家都有。雷竞技手机版app将其用于迁地或原位矿物碳酸化的可行性尚未确定(Brownlow, 1979;Newall等人,2000)。
在较小的范围内,工业废物和采矿尾矿提供了容易获得和反应性的碱性来源。尽管它们的总量太小,无法大幅减少二氧化碳排放,但它们可以帮助引入这项技术。废物流的钙硅酸盐材料已被考虑用于矿物碳酸化的包括来自燃煤发电厂的燃料灰粉(氧化钙含量按重量计高达65%),来自市政的底灰(按重量计约20% CaO)和飞灰(按重量计约35% CaO)固体废物焚化炉,废纸回收的除墨灰(约35%的重量CaO),不锈钢钢渣(约65%的重量CaO和MgO)和废水泥(Johnson, 2000;Fernández Bertos等人,2004;Iizuka等人,2004)。
7.2.4处理
7.2.4.1采矿和矿山复垦
开采蛇纹石与开采其他性质类似的矿物(例如铜矿)的常规开采没有本质区别。蛇纹石和橄榄石都已经被开采了,尽管很少达到这里所设想的规模(戈夫和拉克纳,1998;Goff et al., 2000)。与其他采矿作业一样,尾矿处置和矿山复垦是需要考虑的重要问题。尾矿的处置取决于材料的特性——粒径和黏结力、含水率和相对于自然浸出过程的化学稳定性——而这些又取决于具体的工艺。碳化厂很可能位于金属氧化物材料附近,要么是生产待处理残留物的工厂,要么是硅酸盐矿山,以避免固体材料的运输(见图7.2)。
应用于当今采矿技术的规模经济表明,最低采矿作业为每天5万至10万吨(Hartman, 1992年),这意味着对于一个具有30年寿命的矿山,最低可开采体积约为0.3立方公里。对于蛇绿岩矿体来说,这是一个相当小的尺寸,它们通常有几公里宽,几百米厚(Goff和Lackner, 1998;戈夫等人,2000年;Newall等人,2000)。与蛇绿岩体不同,由于煤赋生在薄煤层中,埋在大量覆盖层下,有人认为,与同等的蛇绿岩矿相比,处理相同数量的碳原子,一个典型的地上煤矿必须移动更多的物质(Lackner et al., 1995)和扰动更大的区域(Ziock and Lackner, 2000),假设矿物最大限度地转化为碳酸盐(燃烧时一个碳原子产生一个CO2分子)。它必须固定在一个碳酸盐分子中)
蛇纹石可以有许多不同的形式,从装饰性的石头到温石棉(O’hanley, 1996)。遇到石棉的可能性需要适当的预防措施。据报道,根据目前的最佳实践,这不会是一个障碍
(Newall et al., 2000)。此外,由于蛇纹石的石棉形式是最活泼的,反应产物预计不含石棉(O'Connor et al., 2000)。因此,矿物碳酸化可以补救在某些地区发生的大型天然石棉危害,例如在加利福尼亚州(Nichols, 2000)。
7.2.4.2矿物预处理
矿物预处理,不包括化学处理步骤,包括破碎、研磨和铣削,以及一些机械分离,例如磁铁矿(Fe3O4)的磁萃取。
7.2.4.3 CO2预处理
矿物碳酸化需要很少的二氧化碳预处理。如果二氧化碳通过管道输送到处理地点,管道操作的限制可能会超过矿物碳酸化的预处理需求。目前的研究状态表明,二氧化碳应在与管道压力相似的压力下使用,因此需要最小或不需要压缩(Lackner, 2002;O'Connor et al., 2002)。碳酸化对纯度的要求是最低的;烟道气中的酸性成分也可以通过同样的过程,因为它们也会被碱中和,并可能以类似的方式予以处置。大多数碳酸化过程会对CO2进行预热,通常在水相过程中加热到100°C至150°C,而在气固反应中温度可达300°C至500°C (Butt等,1996年)。
7.2.4.4碳酸化反应工程
矿物碳酸化最简单的方法是在适当的温度和压力水平下,气体CO2与含金属氧化物的颗粒物质发生反应。不幸的是,这种直接的气固反应太慢,不适用于第7.2.3节中提到的材料(Newall et al., 2000),而且只有在合理的压力下,才适用于精制的稀有材料,如钙和镁的氧化物或氢氧化物(Butt and Lackner, 1997;Bearat et al., 2002;Zevenhoven和Kavaliauskaite, 2004)。因此,没有精制材料的矿物碳酸化不能直接从烟道气体中捕获二氧化碳,但在来自IGCC工厂的加压富二氧化碳气体的情况下可能会这样做。
由于直接将二氧化碳固定在固体未精炼的物质颗粒上目前看来是不可行的,替代方法需要从固体中提取金属。这可以通过将固体材料悬浮在水溶液中,并让其溶解并释放金属离子来实现,例如钙离子或镁离子。这些离子与二氧化碳溶解时在同一溶液中形成的碳酸(H2CO3)接触。当碳酸盐和副产物——例如硅酸盐碳酸化的情况下的二氧化硅——沉淀时,条件就可以实现。这涉及到单步或多步工艺的操作参数的正确选择——特别是温度、可能的添加剂浓度和二氧化碳压力(控制溶液中的碳酸浓度)。在操作结束时,会留下碳酸盐、副产品和未反应的固体物质的细颗粒悬浮液。这些必须通过过滤和干燥从要定量回收的残留金属离子和添加剂的溶液中分离出来。
这种湿法工艺方案目前处于研究阶段,必须克服三个主要障碍,才能具有成本效益,并被认为是碳储存的可行选择:(i)加速工艺的总体速度,这可能受到金属氧化物轴承材料溶解速度的限制;(ii)消除伴随的金属氧化物溶解和之间的干扰碳酸盐沉淀;(iii)如果使用添加剂,则完全回收所有涉及的化学物质。
从天然硅酸盐开始的矿物碳酸化是一个缓慢的过程,可以通过提高温度在动力学上增强,尽管热力学是一个限制因素。在水体系中,这通常保持在200°C以下,因为高温有利于气态CO2而不是沉淀碳酸盐。金属氧化物的溶解被认为是速度限制步骤,大多数研究工作都致力于寻找从固体输入材料中加速金属提取的方法。这可以通过激活矿物使其更不稳定和活性,或者通过在溶液中添加添加剂或催化剂来增强金属氧化物的提取来实现。活化可以采取不同的形式,即在650°C对蛇纹石进行热处理(Barnes et al., 1950;Dragulescu等人,1972;O'Connor等人,2000)和橄榄石和硅灰石的超细(磨损)研磨(O'Connor等人,2002;Kim and Chung, 2002)。据估计,矿物激活的能量成本分别为300千瓦时t-1,热激活和机械激活的能量成本分别为70-150千瓦时t-1 (O’connor等,2005)。经过这样的预处理,碳酸化已经成功地进行了,但它是如此昂贵和能源密集型,其可行性是值得怀疑的(见框7.1和O'Connor et al., 2005)。 Dissolution catalysts that can be added to the aqueous solution include strong and weak acids (Pundsack, 1967; Lackner et al., 1995; Fouda et al., 1996; Park et al., 2003; Maroto-Valer et al., 2005), bases (Blencoe et al., 2003) and chelating agents to extract SiO2 or MgO groups from the mineral (Park et al., 2003). All three approaches have been studied and at least partially experimentally tested, but in all cases catalyst recovery represents the key hurdle. It is worth noting that the carbonation of metal oxides from industrial wastes can be faster than that of natural silicates (Johnson, 2000; Fernández Bertos et al., 2004; Huijgen et al., 2004; Iizuka et al., 2004; Stolaroff et al., 2005).
首次提出用盐酸(HCl)溶解蛇纹石或橄榄石(Houston, 1945;巴恩斯等人,1950年;Wendt等人,1998a)。该过程需要几个步骤来沉淀氢氧化镁(Mg(OH)2),然后它可以直接与气态CO2反应,并回收HCl。放热和吸热步骤交替进行,热量回收并不总是可能的,因此使得整个过程非常耗能且不可用(Wendt等人,1998a;Newall等人,2000年;Lackner, 2002)。同样,强碱溶液(含NaOH)会溶解镁中的二氧化硅
专栏7.1湿法矿物碳酸化工艺。
对单步湿式碳酸化工艺的综合能源和经济评价已被报道(O'Connor等,2005)。虽然仅限于图7.3所示的特定碳酸化过程,但这项研究基于大约600个实验测试,不仅研究了该过程的基本和技术方面,而且还研究了二氧化碳源和潜在汇(在这种情况下是天然硅酸盐沉积物)的匹配。特别值得一提的是,美国有7种大型超镁铁质矿石(两种橄榄石,四种蛇纹石(三种蜥蜴石和一种安高榴石)和一种硅灰石)。其中三个位于西海岸,三个在东海岸,还有一个在德克萨斯州。七种矿石的选择还考虑了区域煤炭消耗和潜在的二氧化碳可用性。
三种不同的矿物表现出不同的反应活性,用在特定的操作条件下一小时后的碳酸化反应程度来衡量。反应程度与矿物预处理之间存在一种权衡,因此,更强烈的预处理可获得更高的反应活性,这代表了能源成本。机械活化对橄榄石和硅灰石是有效的,包括使用传统的棒材和球磨技术能源消耗最高可达100 kWh t1的矿物(标准预处理)和超细研磨,最高可达200 kWh t1的矿物(激活工艺)。前者的转化率不超过60%,后者则高达80%以上。以蛇纹石为例,在磨矿(标准预处理)后,630°C的热活化对抗榴石有效(转化率高达92%),但对蜥蜴石仅部分有效(最大转化率不大于40%),并且需要消耗约350 kWh t1矿物的能量。该湿法工艺的最佳操作条件与矿物有关,橄榄石的最佳操作条件为185℃和15 MPa,热处理蛇纹石的最佳操作条件为155℃和11.5 MPa,硅灰石的最佳操作条件为100℃和4 MPa。在前两种情况下,碳酸化反应发生在0.64 mol L1碳酸氢钠和1 mol L1氯化钠的存在下。
表7.1 CO2的矿物碳酸化储存成本。 |
||||
矿石 |
1小时后转换 |
成本 |
能量输入” |
成本 |
(预处理类型) |
(%) |
(美元/ t矿) |
(千瓦时/ tCO2存储) |
(美元/ tCO2存储) |
橄榄石(标准) |
||||
继续阅读:Lng协议
这篇文章有用吗?
读者的问题
-
黛博拉2个月前
- 回复
-
Fesahaye塞拉西2个月前
- 回复



