信息Fgx

4所示。确认
作者要感谢Drs加里·罗伯茨和丹尼斯·迪恩刺激讨论。从作者的实验室工作是35332年由美国国家拨款支持。
5。引用
艾伦RM et al。(1993)生物。268年化学,23670 - 23674
Bulen佤邦,LeComte小(1966)Proc。国家的。学会科学。美国56岁,979 - 86
填料WA et al .(1986)欧元。学生物化学j。160年,371 - 377
皮质毫米et al。(1992) 257年科学,1653 - 1659
荷马MJ et al。(1995)生物。270年化学,24745 - 24752
杰弗瑞C(1999)学生物化学的趋势。Sci。24日,8 - 11
学生物化学杰弗里C et al。(2000)。39岁,955 - 964
金正日J,里斯直流(1992)科学257,1677 - 1682
学生物化学Paustian TD et al。(1990)。29 (14), 3515 - 3522
波普先生et al . (1985) Proc。国家的。学会科学。美国82年,3173 - 3177
Rangaraj P et al。(2001)生物。276年化学,15968 - 15974
Rangaraj P et al。(1997) Proc。国家的。学会科学。美国94年,11250 - 11255
罗宾逊AC et al。(1987)生物。262年化学,14327 - 14332
Ruttimann-Johnson C et al。(2001)生物。276年化学,4522 - 4526
Ruttimann-Johnson C et al。(2000)在Pedrosa FO, Hungria M,耶茨MG,牛顿我们(ed)固氮:从分子到农作物产量,pp, 35-36 Kluwer学术出版商,多德雷赫特
固氮酶机制:老滞后能教我们新把戏吗?
R.N.F. Thorneley1, h . Angove1 G.A. Ashby1,贝拉Durrant1, S.A. Fairhurst1,
中华民国George1、pc Hallenbeck2 a . Sinclair1 J.D. Tolland1
杂志的部门。化学。约翰英纳斯中心,诺维奇,NR4 7嗯,英国
2离开。德微Immunol。大学,蒙特利尔,加拿大蒙特利尔H3C 3 j7
1。介绍
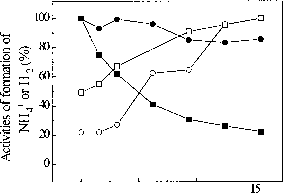
我们对固氮酶的机制的理解仍然是通知的概念,通过实验确定的速率常数和模拟Lowe-Thorneley (1984)。Fe-protein周期描述所需的最小数量的部分反应影响电子的转移从铁蛋白MoFe蛋白质MgATP耦合的两个分子的水解。一个重大的挑战是了解原子分辨率的能量转换反应(电子转移,水解MgATP和构象变化有关),只有发生在瞬态铁和MoFe之间形成复杂的蛋白质。x射线晶体学(Chiu et al . 2001年,引用其中)和小角x射线散射(格罗斯曼et al . 1997年)使用AIF4”,我没有和A127-Fe-protein陷出不同的构象复杂造成了极大地对我们理解这些事件和形式的解释我们的光谱和动力学的基础数据。我们探索了反应的动力学和光谱资料的结构决定因素发生在Fe-protein周期在三个方面:(i)利用ATP模拟2》-deoxyATP;(2)与MgATP定点诱变的残留物;和(iii)的替代4 fe-4s 4 fe-4se集群的集群铁蛋白。
此外,stopped-flow傅里叶变换红外光谱学已经被用于减少叠氮化监控和一氧化碳抑制的研究状态和稳定的状态。这些数据开始有助于我们对化学的理解发生在FeMo-cofactor随之而来的八个连续的电子和质子转移组成的MoFe-protein周期Lowe-Thorneley模型。
2。-deoxyATP ATP模拟2”
2羟基组的ADP核糖的元素是氢连着Glu221铁蛋白(图1)。这种氢键可以很容易地通过使用2》-deoxyATP (ADP)的羟基-
集团是被氢原子所取代。我们学习了许多的局部反应发生在肺炎克雷伯菌(Kp)固氮酶的Fe-protein循环使用2》相比-deoxyATP / ADP和动力学和电子顺磁共振数据与获得
ATP和ADP。增加Fe-chelation从铁蛋白(Kp2)由bathophenanthroline诱导2的-deoxyATP绑定非常类似于观察ATP。2》-DeoxyATP ATP一样,引起轴向变化的菱形的EPR Kp2的信号。减少由Kp2ox S02”(MgADP) 2和Kp2ox (Mg2 -deoxyADP) 2发生在本质上相同的速率(k = 4和5 x 106 'V1,分别)。
f刺45
图1所示。Av2 MgADP结合位点(卡通d·劳森使用坐标的张成泽et al . 2000年)。
我们得出这样的结论:自由铁蛋白2的氢键的羟基组核糖的羧酸盐Glu221并不明显确定蛋白质的构象附近的4 fe-4s集群。x射线结构的叠加的固氮菌vinelandii铁蛋白(Av2)和Av2 (MgADP) 2(张成泽et al . 2000年)显示很少或根本没有运动的氢键当免费Av2经历ADP-induced构象变化。反应发生在Fe-MoFe蛋白质复合体,然而,这个氢键的存在影响动力学数据总结在表1所示。
表1。ATP和动力学数据的比较2的-deoxyATP Kp固氮酶(23°C)
ATP 2》-DeoxyATP
电子转移(k ?150年代~)21
复杂的离解(k3, s”1) 6.4 - 0.8
Sp.Act。(H2 nmole /毫克/分钟)842 112
ATP / 2 e 4.4 - 5.4
还原剂独立的atp酶(s”1) 0.6 - 1.2
更换2》的ATP -deoxyATP降低一阶电子转移速率常数和复杂的离解的八倍。复杂的分离仍然是病原,因为质子还原的具体活动也减少了8倍。的亲和力Mg2的MgATP -deoxyATP约4倍小于计算双曲依赖的电子转换速率(k2)核苷酸浓度。MgATP水解的速度还必须下降了接近八一个因素由于ATP / 2 e”的比例为5.4 2》-deoxyATP是MgATP仅高出25%。事实上,这种差异可以entirely-accounted reductant-independent ATP水解速率的增加与Kpl催化氧化Kp2的复杂,这是Mg2高出两倍的比MgATP -deoxyATP。这些数据表明,电子转移,ATP水解和复杂的离解co-modulated铁蛋白结构的变化随之而来的损失之间的氢键Glu221和2羟基群核糖元素的ATP。检查x射线覆盖的结构Av2 (MgADP) 2和Av2 (MgADP.AlF4) 2提出的张成泽et al。(2000)表明,这后者结构中氢键被破坏。因此,我们建议,因为ATP水解只发生在铁蛋白绑定到MoFe蛋白质,氢键是敏感,导致了自由能的变化对对接前铁蛋白质到MoFe电子转移。
3所示。Asp43Glu Asp43Asn Thr45Ser:开关1地区Av2的突变体
图1显示了Asp43和Ser44氢连着水分子协调Mg2 +离子,进而协调ADP的终端磷酸基。连着Gln54 Thr45是氢。所有这三个残基的信号转导网络Av2 P21ras称为“开关1”的比喻,在这一地区拥有高结构同源性(张成泽et al . 2000年)。我们有构造和特点三Av2变异,Asp43Glu, Asp43Asn Thr45Ser。
EPR谱表明,Av2-Asp43Glu和Av2-Asp43Asn突变体不接受MgATP-induced菱形g = 1.95的轴向变化形式的信号,而Av2-Thre45Ser明显。铁螯合的初始速率增加bathophenanthroline是另一个准则来估计的程度MgATP-induced铁蛋白构象变化。表2中的数据确认Av2-Asp43Glu和Av2-Asp43Asn突变体不接受MgATP-induced构象变化而Av2-Thr45Ser。Av2-Thr45Ser超过三倍增加率(760)相对于野生型Av2(220)非常显著,表明重大的结构性变化的蛋白质环境4 fe-4s集群。然而,这些突变的影响似乎更少的反应
表2。表3初始的铁螯合率的增加。减少氧化Av2
通过bathophenanthroline由MgATP MgADP受S02”(10
Av2-native 220 Av2-native xl06m 1“1”
Av2-Asp43Glu 8 Av2-Asp43Glu 6 x 106“的”
Av2-Asp43Asn 'V1 7 Av2-Asp43Asn 8 x 106米
Av2-Thr45Ser 760 Av2-Thr45Ser xl06m 1“1”
蛋白质的氧化。本机Av2ox的还原利率(MgADP) 2和亚硫酸氢的突变形式(二氧化硫)都是在两倍(表3)。这些清楚地显示这些突变的微分效应取决于Av2氧化水平和是否MgADP MgATP绑定。这很重要因为电子转移和ATP乳沟是早期事件的一系列反应发生在Fe-MoFe蛋白质复合体,和随后的energy-transducing离解反应和病原复杂,必须包括氧化铁蛋白2 mgadp绑定。本机Av2、Av2-Asp43Glu Av2-Asp43Asn Av2-Thr45Ser特定活动的2360,18.5和1100 nmole H2 (min毫克)“1 180年和初级电子转换利率Avl, 5.4,没有检测到,和250年代“1,分别。更高的电子转移(外推值无限MgATP浓度)的k0bS Av2-Thr45Ser(250年代“1)相比,本机Av2(180年代“1)是有趣的和符合其MgATP Fe-chelation诱导率的增加。就好像这个突变体经历比本地Av2 MgATP-induced构象变化略大。然而,复杂的离解,涉及氧化MgADP-bound形式是慢(k。3 = 3.7 s”1)相比,本机Av20X (MgADP) 2 (k。3 = 6.5 s”1)。这将导致突变的双重的特定活动的减少。
Lowe-Thorneley模型的一个预测是,Av2-Thr45Ser突变应该更有效率比本地Av2对电子通量的比例将氢进化的一个大气压下氮但效率会降低对ATP / 2 e”比率。这些预测都是基于稳态浓度的增加Av2ox (MgADP) 2 avl复杂由于复杂的离解的速度较慢。这个抑制氢进化,但增加了reductant-independent atp酶的贡献。电子通量的比例为Av2-Thr45Ser氢进化下氮和本地Av2(分别为27±2.0和32±1.9%),ATP / 2 e比下氩(分别为6.1:1和4.5:1),和kcat reductant-independent ATP酶活性(分别为1.2和0.65)提供了一些证据来支持这个预测。进化可能选择了一个刺速度位置45为了最大化总氨生产和减少大量的ATP水解的效率比较低酶对氢进化。
4所示。更换4 fe-4s 4 fe-4se集群的集群铁蛋白(Kp2)
4 fe-4s Kp2的集群可以删除,添加MgATP之后,通过与bathophenanthroline螯合铁的,其次是在交联葡聚糖凝胶过滤G-50在严格的厌氧条件下手套箱。apo-Kp2可以重组4 fe-4se集群使用seleno-D, l -胱氨酸,亚铁离子、二硫苏糖醇、cysteine-desulphurase (Nif年代,由院长)博士。Se-Kp2蛋白纯化在DEAE纤维素三羟甲基氨基甲烷缓冲液(50毫米,pH值7.4)和筛选了0.4氯化钠,亚硫酸氢2毫米。蛋白质含有等量的铁和Se在3 - 5克每摩尔Kp2原子。
图2显示了EPR谱Se-Kp2特性在g = 5.2 (S = 7/2)和g = 1.95 (S = 1/2)的特点4 fe-4se集群(盖拉德et al . 1986;Yu et al . 1991年)。4 fe-4se集群建模到本机Av2 x射线晶体结构表明,更换年代Se应该几乎没有改变Fe-Fe距离(2.76,2.78 (Se)]。Fe-S之间的差异(2.29)和Fe-Se(2.42)债券的长度使4 Se原子向外移动的铁原子固定的蛋白半胱氨酰硫配体。EXAFS Se-Kp2分析正在进行中(g·乔治和r .王子)。
Se-Kp2都有一个特定的活动大约15%的野生型,但与ATP / 2 e = 17 (cf native-Av2 4.4)。主要电子转移的速率下降到38 s 1“1与180年代“本地Av2,与一个3倍更紧密的绑定MgATP (Kd = 0.15毫米和0.44毫米为本机Av2)。
5。时间分辨的傅里叶变换红外光谱学的叠氮化抑制减少
ca的Lowe-Thorneley模型预测滞后阶段。1 s l减少叠氮化的氨。反应可以通过stopped-flow研究红外光谱使用先前描述的装置(乔治et al。1997年,2000年)通过监控叠氮化的损失在2050厘米”1。一次课程(图3)所示,这显然展品和外推预测滞后阶段,快速初始损失8 | xM叠氮化发生在第一个200 ms。如此大量的叠氮化与钼浓度和化学计量表明每个FeMo-cofactor结合,减少一个相当于叠氮化。减少叠氮化绑定的八个电子之前必须完成第二叠氮化结合,建立了稳态有时超过ca。1。我们还研究了这个反应的抑制一氧化碳的条件下sub-stoichiometric w.r。t帽了ca。叠氮化的抑制率减少50%。没有观察到停滞阶段(< 200 ms)抑制的发生。这是有趣的,因为我们以前监测时间为1904厘米的红外波段的出现“1在低有限条件下(乔治·et al . 1997年)。这个乐队,这是第一个出现在时间进程,将会于长滩举行7秒达到最大强度和开发1 s小于10%。这些数据表明,1904厘米“1物种不能负责的迅速出现抑制减少叠氮化。 We are now seeking, in the technically more difficult region of the IR spectrum where strong protein amide bands absorb g = 5.2

500 1500 2500 3500 4500磁场(高斯)
图2。电子顺磁共振光谱Se-Kp2(底部)MgADP(中间)和MgATP 18 K(上),与缓冲空白减去10兆瓦。
(1500 - 1700厘米”1),新公司物种形成的证据在很短的时间,负责减少叠氮化的抑制。
20.02
20.00
19.96
20.00
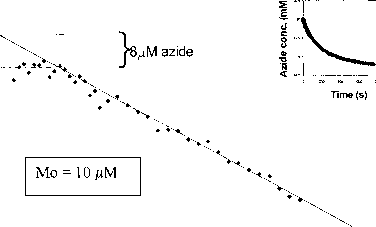
图3。叠氮化Stopped-flow红外光谱时间课程减少显示一秒钟停滞阶段(23°C, pH值7.4)。
6。结论
在本文中,我们展示了如何干扰铁的结构蛋白质的三种方法,即通过三磷酸腺苷类似物、定点诱变腺苷结合网站的残留物,替换的硫化物和硒4 fe-4s集群,可以给新的深入了解蛋白质结构调节部分组成Fe-protein反应周期。此外,substrate-reduction反应发生在MoFe-protein周期正变得平易近人研究通过实时监测stopped-flow红外光谱。
7所示。引用
学生物化学盖拉德J et al。(1986)。25日,464 - 468
乔治SJ et al。(1997) j·阿。化学。Soc。119年,6450 - 6451
乔治SJ et al。(2000)生物。275年化学,33231 - 33237
格罗斯曼詹et al。(1997) j·摩尔。杂志。266年642年-648年
学生物化学张成泽某人et al。(2000)。39岁,14745 - 14752
学生物化学劳DJ, Thorneley RNF (1984)。224年,877 - 886
8。确认
RNFT支持英国生物技术和生物科学研究委员会。感谢BBSRC HA和JT,盖茨比的财政支持的基础。PCH支持标准件在公休假JIC NSERC和英国皇家学会。
叠氮化、氰化物和亚硝酸盐是氧依赖性的固氮酶的新基质嗜热细菌的链霉菌属THERMOAUTOTROPHICUS
椅子上的微生物学、d - 95440拜罗伊特、德国拜罗伊特大学
1。介绍
链霉菌属thermoautotrophicus是一个高温、有氧和预留chemolithoautotrophic细菌(Gadkari et al . 1990年)。它能够解决公司二氮或H2 +二氧化碳作为生长基质(Gadkari et al . 1992年,Ribbe et al . 1997年)。美国thermoautotrophicus由三个酶的固氮酶heterotrimeric Mo-dinitrogenase (Stl),一个二聚的Mn-superoxide氧化还原酶(St2)和heterotrimeric Mo-carbon一氧化脱氢酶(CODH或St3)。这三种酶分子氧不敏感;事实上,分子氧是一个重要的中间(Ribbe et al . 1997年)。CODH氧化CO和转移电子释放氧气(O2),从而产生过氧化物(O2)•Mn-superoxide的氧化还原酶reoxidizes O2”O2和转移电子Mo-dinitrogenase,反过来,减少二氮,铵。与电子耦合通过铁氧还蛋白/ flavodoxin固氮酶,s . thermoautotrophicus酶建立一个通过O2分子耦合。超氧化物氧化还原酶的氨基酸序列,指定SdnO,非常类似于超氧化物歧化酶(SOD)的细菌(Hofmann-Findeklee et al . 2000年)。的氨基酸序列三SdnM sdn和SdnL多肽(Hofmann-Findeklee et al . 2000年)非常类似于相应的子单元的结构特点CODH Oligotropha carboxidovorans (Gremer et al . 2000年)。
“传统”Mo-containing固氮酶是多才多艺的,减少低分子量化合物含有n n, N-O,碳氮和碳碳双键或三键(伯吉斯1993)和一氧化碳(CO)是一个非竞争性抑制剂的基质除了H +(哈代et al . 1965;Rivera-Ortiz,伯1975;范教授,伯吉斯1993)。相比之下,美国的固氮酶thermoautotrophicus不能降低乙炔乙烯或乙烷(Ribbe et al . 1997年)。Schollhorn和伯里斯(1967)显示,减少叠氮化和凯利et al。(1967)减少氰化物,供应HCN作为衬底和CN”作为一个强有力的抑制剂。这两个物种的比例是pH值的依赖(李等人。1982)。减少亚硝酸盐的NH ^固氮酶报道(沃恩,伯吉斯1989),然而,很少有人了解NO2”作为衬底。
一氧化碳脱氢酶(CODH) carboxidotrophic代谢的关键酶。这是一个铜molybdenum-iron-sulfur黄素蛋白(Gremer et al . 2001年),其氧化CO, CO2使用水作为氧化剂来获得carboxidotrophic增长的能源(梅耶,施莱格尔1980)。的晶体结构CODH已经解决(Dobbek et al . 1999;梅尔et al . 2000年)。直到现在,N3”CODH NH /,减少使用亚硫酸氢作为电子供体,还没有被证明。在这里,我们报告的纯化固氮酶s thermoautotrophicus可以减少叠氮化,氰化物,NH4和N02 ~ !MgATP和亚硫酸氢,并展示公司的影响在减少衬底和H2的形成。此外,我们表明,CODH (St3酶)的美国thermoautotrophicus叠氮化可以减少NH4 +,这进一步增加了两个酶系统之间的类比。
2。实验程序
美国thermoautotrophicus UBT1 (DSM 41605,写明ATCC 49746)生长chemolitho-autotrophically有限公司作为唯一碳源和能源矿产中(梅耶,施莱格尔1980)包含NH4C1(28毫米)78% (v / v)的气体混合物的空气,13%的公司和9%的二氧化碳(Ribbe et al . 1997年)。
Crade提取准备通过细菌悬浮液(50 - 60 g细胞湿重悬浮在50 - 60毫升的50 mM磷酸钾缓冲,pH值7.7,包含0.5毫米phenylmethylsulfonyl氟化物和一些晶体DNase) 5到6次通过法国压力细胞氧化的条件下最大压力然后受到低旋转离心。细胞质分数获得超离心,然后(70 - 80毫升)加载到一个15厘米x 2.6厘米阴离子交换源30 q (Amersham淀粉微球生物科技)列,平衡与25毫米磷酸钾缓冲(pH值7.7)。洗脱和225毫升25毫米磷酸钾缓冲(pH值7.7)是紧随其后的是0到0.6的一个线性梯度氯化钠在磷酸盐缓冲剂。St2蛋白不绑定源30 q和筛选了第一个80 - 160毫升。蛋白质,Stl和St3筛选了近约为0.3 M氯化钠。分数与ammonium-forming活动(Stl蛋白质)合用,补充了1.2 K2HPO4 / HCI缓冲区(pH值7.7),搅拌15分钟。沉淀蛋白质被low-spin离心去除。上层清液(80 - 100毫升)加载到疏水作用层析柱(13厘米2.6厘米;源15 iso, Amersham法玛西亚生物技术),平衡与1 M K2HPO4 / HCI缓冲区(pH值7.7)。的蛋白质被筛选了225毫升的平衡缓冲,紧随其后的是450毫升的线性梯度下降(1.2 0 M)。描述的St2蛋白质纯化(Ribbe et al . 1997年)。
固氮酶化验进行如前所述遵循NFLi从N2 +形成靛酚法(Ribbe et al . 1997年)。CODH活动测量光谱方法iodonitro-tetrazolium氯(INT)作为电子受体(德国人et al . 1989年)。分析了氢进化HgO转换成汞在跟踪分析RGD2减少气体探测器(Gadkari et al . 1990年)。分析了二氮气相色谱仪使用标准方法。解决方案KCN, NaN3和KNO2准备在50 mM KH2P04 / Na0H缓冲区(pH值7.5)。
3所示。叠氮化物作为底物
在适当的试验条件下,连二亚硫酸盐作为电子供体,纯化固氮酶组件,Stl和St2能够催化还原的叠氮化铵(图1)。形成活动的最大NH4 + 1.29 (imole NH4 + h”1 x mg-1叠氮化25毫米。浓度超过25毫米既不增加也不抑制活动。
图1显示了时间进程形成铵的纯化s thermoautotrophicus固氮酶N2的存在与否或叠氮化。在65°C 1 h孵化后,形成的控制铵是0.10毫米,而形成铵与叠氮化在氮气或氦气气氛0.46毫米和0.51毫米,分别。孵化后6 h,活动与叠氮化在二氮或氦增加3.9倍和4.6倍,分别与控制。显然,叠氮化物衬底,它只产生在N2和NH4 + 1.4摩尔比率。叠氮化减少NFLt + 2.38毫米的基米-雷克南和26.6 nmole Fmax NFLt +形成(min毫克)”1。
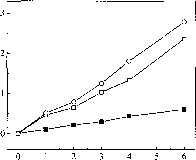
图1所示。从叠氮化铵形成。反应混合物中含有2.3毫升KH2P04 / Na0H缓冲区(50毫米,pH值7.5),2.5毫米ATP, MgCl2 5.0毫米,10.0毫米亚硫酸氢,0.82毫克Stl, 0.13毫克St2和25毫米NaN3表示。化验进行在65°c .■100% N2下没有叠氮化;□,100% N2下叠氮化;叠氮化和O,低于100%的氦。
图1所示。从叠氮化铵形成。反应混合物中含有2.3毫升KH2P04 / Na0H缓冲区(50毫米,pH值7.5),2.5毫米ATP, MgCl2 5.0毫米,10.0毫米亚硫酸氢,0.82毫克Stl, 0.13毫克St2和25毫米NaN3表示。化验进行在65°c .■100% N2下没有叠氮化;□,100% N2下叠氮化;叠氮化和O,低于100%的氦。
5 10
在化验瓶%股份有限公司
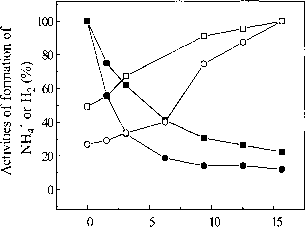
图2。公司对NH4 +的影响和H2形成由Stl和St2叠氮化。反应混合物是如图1所示,但25毫米NaN3和各种CO浓度。分析了NH4 + 4 h后在N2 65°C。■,NH4 +形成没有叠氮化;□,H2形成没有叠氮化;NH4 +形成与叠氮化;O, H2和叠氮化形成的。NH4 ~ 1.6 | imol (h.mg)“1和0.28 jtmol (h.mg)”1被设置为100%,没有叠氮化,分别。 For H2, 0.13 |amol (h.mg)"1 and 0.43 umol (h.mg)"1 were set as 100% with and without azide, respectively.
3.1。减少一氧化碳对叠氮化的影响。有限公司是一个强大的非竞争性抑制剂的基质除了“传统”固氮酶的质子(哈代et al . 1965;Bulen et al . 1965;黄et al . 1973年)。具体影响底物还原网站没有干涉MgATP的酶催化水解。
图2显示,增加公司,减少叠氮化(25毫米)相应减少。叠氮化在65°C, NH4 +形成害怕没有有限公司是1.61(摩尔h 1 x 1毫克。然而,有15%的公司只有0.19 (j。摩尔h“1 x毫克”1,即只有11.8%,如果没有公司。在分析N2(控制)缺乏有限的情况下,该活动是0.28 fimole h 1 x毫克1和,在15%的公司,只有0.061(摩尔h“1 x毫克”1,这是21.8%的,如果没有有限公司在化验(有或没有叠氮化)与公司存在,H2进化的增加,这与CO浓度。4 h孵化后,NH44比“没有有限公司是1:0.18 H2控制试验,改变与增加有限公司有限公司15%,这个比例是1:1.6(图2),表明大部分的电子被转移到质子。类似的变化观察这个比例从1:0.015 1:0.45没有加入叠氮化和有限公司(15%),分别为。虽然这些结果显示一个类似的公司模式抑制固氮酶“传统”,抑制所需的公司是明显更高。
4所示。氰化物作为底物
氰化物也可以减少Stl和St2组件(图3)。氰化物的最大浓度,由Stl和St2容忍
组件,20毫米,高于这个浓度,活性下降,在25毫米,完全停止了。
5 10
在化验瓶%股份有限公司
图2。公司对NH4 +的影响和H2形成由Stl和St2叠氮化。反应混合物是如图1所示,但25毫米NaN3和各种CO浓度。分析了NH4 + 4 h后在N2 65°C。■,NH4 +形成没有叠氮化;□,H2形成没有叠氮化;NH4 +形成与叠氮化;O, H2和叠氮化形成的。NH4 ~ 1.6 | imol (h.mg)“1和0.28 jtmol (h.mg)”1被设置为100%,没有叠氮化,分别。 For H2, 0.13 |amol (h.mg)"1 and 0.43 umol (h.mg)"1 were set as 100% with and without azide, respectively.
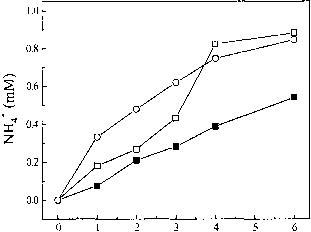
图3。从氰化物催化形成铵净化Stl和St2组件。反应混合物如图1 + 10毫米KCN表示。分析在65°C下100% N2或他:■,没有氮气下氰化物;氰化物在N2;啊,他与氰化物在100%以下。
图3。从氰化物催化形成铵净化Stl和St2组件。反应混合物如图1 + 10毫米KCN表示。分析在65°C下100% N2或他:■,没有氮气下氰化物;氰化物在N2;啊,他与氰化物在100%以下。
在10毫米KCN最大活动0.42 pmole铵
形成铵KCN或N2的存在。反应发生相似的效率存在和N2的缺失
(图3)。6 h后的孵化
65°C, NH4 +的形成
(控制)是0.45毫米,这表明氰化物可能是首选。KCN
降低了NH4 + 5.21公里的
毫米和16.7 nmole Fraax NH4 +
形成(最低1 x毫克1)。这些值的范围(公里的1.1毫米
4.5和113到158 nmole Vmax min”1 x 1
h 1 x 1毫克。图3显示了
0 5 10
在化验瓶%股份有限公司
图4。公司对NH4 +的影响和H2形成氰化物N2下Stl和St2组件。反应混合物与10毫米KCN如图1所示,公司表示。NH4 + 4 h后分析了65°c .■NH4 +没有KCN形成;没有KCN□, H2形成;与KCN NH /形成;O, H2形成KCN。对NH4 + 0.67 nmole (h.mg)“1和0.28¡xmol (h.mg)”有和没有KCN 1被设置为100%,分别。H2, 0.11
“传统”固氮酶毫克)报告(李et al . 1982;沈et al . 1997年)。
4.1。减少一氧化碳对氰化物的影响。越来越多的公司(15%)几乎不影响KCN减少(图4)。在缺乏有限公司NH4 +形成0.67 j-imol (h.mg)" 1,而15%的公司,它是0.57 ^ imol (h.mg)”1。此外,即使47%的公司并不影响NH4 +形成(结果未显示),然而,FL形成增加;4倍公司为15%。
5。亚硝酸盐作为底物
在适当的试验条件下以亚硫酸氢为电子供体,固氮酶组件Stl和St2能够促进减少二氧化氮“NH4 +线性9毫米N02”。在65°C,具体活动的控制没有NO2“0.82 | _miole NH4 + h”1 x毫克1,而9毫米NO2, 1.60 ^ imole NH4 + h 1 x 1毫克。更高浓度的抑制,35毫米N02”,形成铵比控制没有NO2”减少了27%。沃恩和伯吉斯(1989)观察到,在60毫米,亚硝酸盐是一种铁蛋白的抑制剂。在我们的实验MgATP和亚硫酸氢St2蛋白就能减少二氧化氮”慢慢(0.3 jimole NH4 + h 1 x毫克1),即使在35毫米NO2浓度”
0 5 10
在化验瓶%股份有限公司
图4。公司对NH4 +的影响和H2形成氰化物N2下Stl和St2组件。反应混合物与10毫米KCN如图1所示,公司表示。NH4 + 4 h后分析了65°c .■NH4 +没有KCN形成;没有KCN□, H2形成;与KCN NH /形成;O, H2形成KCN。对NH4 + 0.67 nmole (h.mg)“1和0.28¡xmol (h.mg)”有和没有KCN 1被设置为100%,分别。H2, 0.11
(imol (h.mg)“1和0.43 (imol (h.mg)”分别为1和没有KCN。
设置为100%
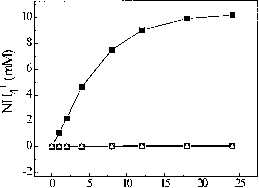
图5。叠氮化铵由CODH(10毫米)催化。反应混合物包含2毫升KH2P04 / Na0H缓冲区(50毫米,pH值7.5),CODH亚硫酸氢10毫米和2.8毫克。化验下100% N2 65°C。亚硫酸氢CODH + + N3;□,CODH + N3”;CODH +亚硫酸氢;连二亚硫酸盐+ N3”。
图5。叠氮化铵由CODH(10毫米)催化。反应混合物包含2毫升KH2P04 / Na0H缓冲区(50毫米,pH值7.5),CODH亚硫酸氢10毫米和2.8毫克。化验下100% N2 65°C。亚硫酸氢CODH + + N3;□,CODH + N3”;CODH +亚硫酸氢;连二亚硫酸盐+ N3”。
,这表明35毫米NO2“抑制只Stl蛋白质的活性。NO2”简化为NH4 +公里的2.79毫米和27.9 nmole NH4 +的Vmax形成(min.g)”1。
6。减少一氧化碳的叠氮化脱氢酶(St3蛋白质)
使用适当的条件与亚硫酸氢作为电子供体,美国的纯化CODH thermoautotrophicus叠氮化能够催化减少NH4 +和N2(图5)。在65°C 25 h后,总NH4 +测量是10.18毫米。控制瓶,只有CODH CODH加亚硫酸氢或CODH加N3”,无论是NH4 + N2成立。
在叠氮化(5毫米)减少,NH4 + 5.16毫米和5.20毫米N2形成。据:帝尔沃斯历史学和Thorneley(1981),可以减少叠氮化的以下三个方程:
N3“e + H + 3 + 2”N2 +氨(1)
N3“e + H + 7 + 3”N2H4 +氨(2)
N3“e + H + 9 + 8”——»3氨(3)
因为NH4 +和N2形成化学计量比,这种酶似乎符合反应(1)操作。
7所示。讨论
许多替代基质为“传统”固氮酶是已知的。所有这些的结构基因和代数余子式固氮酶是高度相似。的oxygen-insensitive固氮酶的美国thermoautotrophicus (St-nitrogenase)是由基因和结构不同于“传统”固氮酶(Hofmann-Findeklee et al . 2000年)。Stl的主要序列显示高同源性molybdenum-containing羟化酶,尤其是从Oligotropha CODH carboxidovorans, Hydrogenophaga pseudoflava和假单胞菌thermocarboxydovorans (Hofmann-Findeklee et al . 2000年)。St2 Mn-containing杆高度同源(Hofmann-Findeklee et al . 2000年)。功能区别Stl / St2系统和“传统”固氮酶是前者无法降低乙炔。因此,它并不明显,St-nitrogenase将减少“传统”固氮酶的基质,但叠氮化、氰化物和亚硝酸盐确实会作为St-nitrogenase基质。然而,也有一些差异。
首先,所需的CO浓度(15%)抑制减少叠氮化是“传统”远高于固氮酶(0.5 -2.0%)。第二,即使有47%的公司,减少氰化物是难以抑制。第三,亚硝酸盐不抑制St2活动;相反,St2能够减少亚硝酸盐NH4 +。第四,获得的结果与叠氮化或多或少与其他固氮酶的已知结果一致(图1,图2)。第五,叠氮化有限公司抑制减少St-nitrogenase NH4 +,也同时刺激H2的生产。然而,抑制所需的CO浓度远高于常规固氮酶,表明,St-nitrogenase,公司似乎行动而不是作为一个非竞争性抑制剂,但作为一个竞争性抑制剂。抑制由公司依赖于叠氮化和CO浓度的比值。第六,公司是一个非竞争性抑制剂减少氰化物的“传统”固氮酶,然而,47%的公司几乎没有影响St-nitrogenase减少氰化物。看来,公司可能不作为抑制剂St-nitrogenase但刺激H2进化(图4)。
公司可以产生许多不同的影响。一个改变a vinelandii MoFe蛋白质,aGly69取而代之的是丝氨酸,遭受竞争性抑制减少基质而非竞争性的公司(克里斯琴森et al . 2000年)。同时,突变的a . vinelandii MoFe的蛋白质-谷氨酰胺- 191残渣是赖氨酸所取代,表现出抑制质子减少50%股份有限公司(Kim et al . 1995年)。此外,在低浓度时,公司充当兴奋剂的V-nitrogenase a vinelandii(卡梅隆,黑尔斯1996)。相比之下,美国thermoautotrophicus carboxidotrophic细菌生长在45 - 50%股份,正如预期的那样,公司不施加太多,如果有的话)的抑制作用在St-nitrogenase以叠氮化所需的高CO浓度抑制减少。因此,叠氮化和氰化物不能绑定与Stl亲和力相似组件。亚硝酸盐还原通过Stl符合以前的报告(沃恩,伯吉斯1989),然而,虽然亚硝酸盐抑制固氮酶的“传统”的Fe-protein活动影响其4 fe-4s中心St-nitrogenase St2组件,它不包含Fe-S中心,不抑制亚硝酸盐。相反,St2蛋白质就能减少NH /亚硝酸盐。
CODH (St3蛋白质)也可以减少NFLt +叠氮化。St3和Stl的区别在于,减少衬底Stl需要St2 + MgATP和亚硫酸氢,而St3亚硫酸氢只需要减少叠氮化。由于Stl的结构基因和St3高度同源,难怪St3也可以减少叠氮化NH4 +。可能许多其他化合物,这对固氮酶作为基质,可以减少St-CODH。然而,一般而言,CODHs需氧细菌有氧化的角色而固氮酶是还原。Stl组件是一个heterotrimeric单体和至少像发生在s thermoautotrophicus CODH物种之一。类似于“传统”固氮酶,Stl可以减少N2,叠氮化、氰化物、亚硝酸盐。St-nitrogenase完全不同于“传统的”固氮酶(Ribbe et al . 1997年)和它仍然感兴趣的知道为什么这两个酶,尽管这些差异,或多或少的反应同样对减少这些基质。
8。引用
Bulen et al。(1965)在圣皮特(ed)非血红素铁蛋白:在能量转换作用,页。107 - 112年,安提阿出版社,黄色的弹簧,哦,伯吉斯B,劳DJ(1996)化学。启96,2983 - 3011年卡梅隆LM,黑尔斯BJ (1996) j。化学。Soc。118年,279 - 280年克里斯琴森J et al。(2000)生物。化学。275年,36104 - 36107:帝尔沃斯历史学MJ, Thorneley RNF学生物化学(1981)。j . 193, 971 - 983 Dobbek et al。(1999) Proc。国家的。学会科学。美国96年、8884 - 8889年Gadkari D et al。(1990):。环绕。Microbiol。56岁,3227 - 3234年Gadkari D et al。(1992) j . Bacterid。174年,26627 - 26633年Gremer L et al。(2000)生物。 Chem. 275,1864-1872 Gremer L et al. (2001) Biospectrum
学生物化学哈迪RWF et al。(1965)。Biophys。Commun >, 539 - 544 Hofmann-Findeklee C et al .(2000)在Pedrosa FO,匈牙利,耶茨G,牛顿我们(ed)固氮:从分子到农作物产量,pp, 23-30血案》,黄多德雷赫特JC et al .(1973)生物化学。Biophys。292年学报,256 - 270年凯利M et al。(1967)生物化学。j . 102 lc-3c金CH et al。(1995)生物化学。34岁,2798 - 2808年的德国人et al .(1989)拱。Microbiol。152年,335 - 341年学生物化学李詹et al。(1982)。21日4393 - 4402迈耶OM, Schlegel GH (1980) j . Bacteriol。141年,74 - 80
梅尔OM et al。(1993)在马雷尔JC,凯利DP (ed)微生物增长Ci化合物,页83 - 90,美国微生物学会,华盛顿特区梅尔OM et al。(2000)杂志。化学。381年,865 - 876 (Pham DN, 32岁的伯吉斯BK学生物化学(1993)。13725 - 13731年Ribbe M et al。(1997)生物。272年化学,26627 - 26633年Rivera-Ortiz JM,伯恩斯RH (1975) j . Bacteriol。123年,537 - 545年Schollhorn R,伯RH (1967) Proc。国家的。学会科学。美国57岁的沈1317 - 1323 J et al .(1997)生物化学。36岁,4884 - 4894沃恩SA,伯吉斯BK(1989)生物化学。28岁,419 - 424
第二节:细菌基因组学
继续阅读:固氮藻青菌的基因组分析念珠藻属Punctiforme
这篇文章有用吗?
读者的问题
-
丽娜3个月前
- 回复