降水
11.1降水原理
沉淀在一个严格的化学感觉是过渡的一种物质溶解状态non-dissolved国家之外的其他试剂(溶解),导致沉淀的形成。
然而,如果化学物质导致降水被添加到水,例如等反应也可能发生凝固。因此,在任何实际的应用降水过程往往很难区分这些反应。只有一个详细的知识的基础上的(浪费)水的成分矩阵可以描述过程的方向进步,即。反应倾向,或反应是抑制。
降水是通过特定的金属离子和阴离子之间的反应,例如:
Cu2 + + C032 - < = > CuC03 (11.1)
地表水,孔隙水,有优势的以下阴离子:氯化物、硫酸盐、碳酸盐,碳酸氢盐,减少条件下氢氧化,阴离子物种来自硫化氢。氯化物和硫酸盐的常见金属很容易溶解,而碳酸盐、氢氧化物和硫化物只有溶解困难。
氢氧化物沉淀在几种形式,表现完全不同对合作的影响降水或稍后再溶解。沉淀可能会持续在亚稳平衡解决方案,可能会慢慢转换为老年人形式,从而变得更加稳定和不活跃的。
溶解度是高度依赖于pH值,作为氢氧化沉淀离子的浓度,碳酸盐或硫化物,随pH值减少由于与氢离子反应:
C032”+ H + < = > HC03-S2”+ H + < = > HS -
HC03 - + H + < = > H2C03 = 3 +二氧化碳(g)海关“+ H + < = >硫化氢(g)
随着pH值增加,碳酸盐和氢氧化物成为许多金属离子的稳定阶段。硫化还原电位为负的,仍然是稳定相pH值范围宽对许多金属离子。
各种相互作用的过程,在不同的pH值可以方便地确定溶解度图形所示双对数表示;见下文。
蛋白水解物种的浓度为特征的总碱度,,博士总数是多少碱度是由添加过多的酸标准(例如,0.1),沸腾的二氧化碳形成和回滴定的pH值6。在这个过程中所有的碳酸根和碳酸氢转化为二氧化碳是驱逐和硼酸转化为硼酸。酸的量(即使用。,使用的酸添加-碱滴定法)然后对应碱度,,和下面的方程是有效的;
C =浓度在摩尔每升的指示物种。
换句话说碱度是氢离子的浓度,可以被蛋白水解物种出现在样品检查。显然,碱度越高,更好的解决方案是能够保持给定的pH值如果酸补充道。缓冲能力和碱度比例(见例如作声响和摩根,1981)。
每个蛋白水解物种的水生系统有一个平衡常数。如果我们考虑酸HA和离解过程:
Al - CH2B03 + 2 cc032 + CB03 - + (C0H - - CH +) (11.7)
我们有:
Ka =平衡常数。
它是可能的,当水生系统的构成,计算碱度和缓冲能力,使用的表达式平衡常数。然而,更方便地使用这些表达式在对数形式。如果我们考虑为弱酸,Ka的表达式的一般表达式(11.9),可用于对数形式:
pH = pKa + log_ = pKa +日志(”)——日志(HA) (11.10)
方程两边乘以1和使用符号p H +日志的日志和pH值。
情节通常是方便的HA浓度和pH值”与对数图。如果C表示总浓度C =[哈哈]+[“,我们在低pH值:
这意味着日志(~)pH值增加线性增加,斜率是+ 1。线穿过(日志C, pKa) pH = pKa给日志(")=日志C,相应地,在高pH值,(“)= C和日志(HA) = pKa - pH值+ logC (11.13)
这意味着日志(HA)随pH值增加,斜率是1。这条线也经过(logC pKa)。
在pH = pKa,[-] =[哈哈]= C / 2或日志日志[哈哈]=[-]=日志C - 0.3
表11.1和图11.1显示的结果,这些因素为单个酸碱系统。
注意,在pH值为H2A斜率将2 > pK2,对应2 h +的分离:
H2A = 2 h + + A2”和“A2斜率将+ 2 pH < pK。这是显示在图11.2。
13日,缓冲能力,定义为dC /衰变时,C是添加的酸或碱分别在摩尔的氢或氢氧根离子。
因此可以证明:
日志的pH值(HA) = C,只有(H30 +)扮演了一个角色。
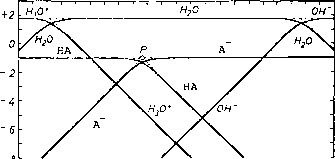
图11.1。H30 +哦”,HA和“策划与pH值为弱酸pKa = 4.64和C = 0.1 M。
继续阅读:浓磷酸的相图
这篇文章有用吗?