通过模型驱动的实验室和介观研究,获得对棕囊藻spp Prymnesiophyceae的综合理解
Stuart J. Whipple•Bernard C. Patten•Peter G. Verity•Marc E. Frischer•Jeremy D. Long•Jens C. Nejstgaard•Jon T. Anderson•Anita Jacobsen•Aud Larsen•Joaquin Martinez-Martinez•Stuart R. Borrett
收稿日期:2006年4月20日/收稿日期:2006年9月7日/在线出版日期:2007年3月8日©施普林格Science+Business Media B.V. 2007
了解Phaeocystis复杂的生命周期是了解其在海洋生态系统和全球生物地球化学中的作用的关键。对现有的生命周期模型进行了修改,并用于整合Phaeocystis的理解
S. J. Whipple•P. G. Verity•M. E. Frischer Skidaway海洋研究所,萨凡纳,佐治亚州,美国
乔治亚大学生态研究所,雅典,
Ga, 30602,美国
电子邮件:(电子邮件保护)
美国东北大学海洋科学中心
J. C. Nejstgaard•A. Jacobsen•A. Larsen卑尔根大学生物系,卑尔根,挪威
j·t·安德森
美国摩根州立大学河口研究中心
J. Martinez-Martinez普利茅斯海洋实验室,英国德文郡普利茅斯
计算学习实验室,斯坦福大学,斯坦福,加州,美国
生命周期。在模型驱动的研究中,模型暴露了我们理解中的差距,实证研究随之而来,反馈提高了理解。按照这个方案,这里考察了生命周期模型的三个方面。除了四个例外,所描述的实证研究已经在其他文献引用中提出。第一个方面涉及测试一个过程的存在或生成它的描述。这些研究包括:体外菌落分裂的示范棕囊藻属pouchetii但是此属,描述与衰老相关的P. pouchetii菌落形状的体外变化,确定P. pouchetii生命阶段易受病毒感染和裂解,并设计了一项实验,以确定沉积物是否可能成为上覆水域新的Phaeocystis菌落的来源;结果表明,有必要对底栖生物颗粒作为菌落形成的物理底物进行更详细的研究。第二个方面涉及过程速率量化或过程控制参数的调查。过程速率量化包括利用介宇宙衍生的菌落测量菌落分裂速率和生长速率。过程控制实验包括测试硅藻对小囊藻集落形成的促进作用,以及研究硅藻对小囊藻中浮游动物的抑制作用和微浮游动物的促进作用棕囊藻属globosa但是此属浮游食草动物信息化学物质的菌落形成。第三个方面是关于球形假单胞菌和菌落间遗传差异的分子鉴定。这些研究旨在为单细胞和集落生命阶段之间的过渡所涉及的控制因素的问题提供洞察。生命周期模型为将经验研究的新见解和理解纳入现有模型提供了一个现成的场所,并可用于改进Phaeocystis对全球生物地球化学的直接和间接影响的模拟模型。
关键词概念模型生命周期中观模型驱动研究棕囊藻
简介
Phaeocystis属包含可能在全球生物地球化学中发挥重要作用的物种(Smith Jr et al. 1991;兰斯洛特等人1994;Wass-mann et al. 2005)。它们发生在广泛的区域(Stefansson和Olafsson 1991;Lancelot和Rousseau 1994年),供应全球二甲基硫化物(DMS;Gabric et al. 1999;Ayers和Gillett 2000),并在浮游生态系统中发挥关键作用(Verity和smetaek 1996;Lancelot et al. 1998)。棕囊藻生命周期过程可能对生态系统的生物地球化学过程产生重要影响,包括棕囊藻生命形式对养分的吸收和再生、病毒裂解对养分的释放、浮游动物放牧对养分的释放以及衰老菌落对养分的释放。关于Phaeocystis生命周期的当前知识状态的细节在Rousseau等人(在出版社,这一卷)中得到了全面的回顾。 In order to integrate understanding of the Phaeocystis life cycle, a conceptual model was constructed (Whipple et al. 2005a), although the existence of some life stages was uncertain and the controls on many of the processes were poorly understood. This exercise highlighted experiments which could provide a better understanding of the role of the life cycle in species dynamics生态系统过程.
这种增强的理解将被纳入一个发展中的概念模型(Whipple et al. 2005a),也将被纳入一个生态系统模型,其中Phaeocystis生命周期仅为一组生物区室(Whipple et al. unpubl.)。在模型驱动的研究中,模型暴露了我们对phaoe -囊虫生命周期嵌入其生态系统的理解中的差距;随之而来的是解决这些差距的实证研究,来自这个周期迭代的反馈提高了理解。本文介绍了Phaeocystis生命周期模型如何被用于指导Phaeocystis生命周期及其生态学的研究的例子,并演示了如何从这些研究中获得的见解整合到概念模型背景中,以增强和整合这些实证发现。
模型描述
Phaeocystis的生命周期根据Whipple等人(2005a)提出的模型进行了修改,以二倍体孤细胞(Diploid lone Cells)为起点,从图1左上方开始顺时针向前推进。这些细胞往返于新殖民地,这是孤独生命形式和殖民地生命形式之间的关键过渡阶段。
在新的菌落细胞第一次分裂后,它们转移到正在生长的小菌落室。成熟继续通过大小类:小!媒介!大的通过有丝分裂和粘液生产集落细胞。通过群体划分,也存在从较大的类向较小的类的反向转移(Whipple et al. 2005b)。
当菌落开始失去细胞时,生长的菌落被转移到相应大小的衰老菌落。二倍体或单倍体单细胞从这些释放完成Phaeocystis生命周期。在四种形成集落的Phaeocystis物种中,单倍体鞭毛虫仅在球形Phaeocystis globosa中有记录(Eilert-sen 1989;雅各布森2002;Medlin和Zingone正在印刷,这一卷;卢梭等人在出版社,这卷)。二倍体单株细胞的另一个生命周期输入来自于新的集落细胞的转化。在任何Phaeocystis物种中都没有记录到同性交配;然而,它已经被包括在模型中,因为假设在P. globosa的集落形成之前,有必要从hap-loid细胞中产生二倍体孤立细胞(Rousseau et al. in press, this volume)。因为这
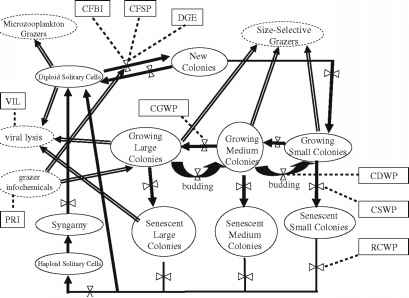
图1棕囊藻生命周期图。实线椭圆形:棕囊藻生命周期阶段;虚线椭圆:其他生态系统组件。实箭头:生命周期转换;空心线箭头:Phaeocystis的输入或输出。[X]
符号:生命周期转换的速率控制。带首字母缩略词的矩形:用虚线指向相关生命周期阶段或生命周期过渡的实证研究
图1棕囊藻生命周期图。实线椭圆形:棕囊藻生命周期阶段;虚线椭圆:其他生态系统组件。实箭头:生命周期转换;空心线箭头:Phaeocystis的输入或输出。[X]
符号:生命周期转换的速率控制。带首字母缩略词的矩形:用虚线指向相关生命周期阶段或生命周期过渡的实证研究
描述的实验名称和首字母缩写:
CDWP在孔板中的菌落划分
CFSP菌落形成与种子颗粒
有底栖生物参与的群落形成
孔板菌落生长
孔板菌落老化
差异基因表达
PRI棕囊藻对信息化学品的反应
孔板中菌落细胞的释放
VIL病毒感染和裂解模型被开发来代表Phaeocystis属,包括单倍体生命阶段,但可能只发生在某些物种(Whipple et al. 2005a)。
图1中的空心箭头表示流入或流出更大生态系统中非棕囊藻组分的假设流量。在某些情况下,它们作为生命周期流的控制,在其他情况下,它们是Phaeocystis生命周期的边界输入或输出。从Phaeocystis生命周期的三个主要输出表示。其中两只正在啃食孤立细胞(左上),另一只正在啃食各种大小的生长菌落(右上)。第三个是病毒裂解(中左),这是病毒研究中通常强调的输出过程。然而,感染是病毒完成其生命周期并对Phaeocystis细胞产生影响所必须发生的输入过程。最后一个过程是将浮游动物(左下)的信息化学物质输入到Phaeocystis的孤立细胞到集落转化或集落细胞。
案例研究
本文的概念模型有两个功能:(1)提供一个整合已知内容的背景,(2)定义观测和实验以消除未知(Whip-ple et al. 2005a)。图1形象地描述了棕囊藻生命周期模型和为解决未知问题而进行的实证研究可能是相互关联的;下面描述的我们研究小组中的每个实验都用缩写词表示
表1本文所讨论的Phaeocystis生命周期过程描述及相关研究
图1中使用的首字母缩写名称过程描述
CDWP在孔板中的菌落划分
有底栖生物参与的群落形成
CFSP菌落形成与种子颗粒
孔板菌落生长
孔板菌落老化
差异基因表达
PRI棕囊藻对信息化学品的反应
孔板中集落细胞的释放SIM物种鉴定
VIL病毒感染和裂解
(例如,VIL =病毒感染和裂解;中左)表示它与生命周期的关系。本文所考虑的九个过程及其相关研究在其生命周期背景下如图1所示。这些过程的描述,它们的首字母缩写和数据源如表1所示;还包括描述在介界研究(SIM)中发现的Phaeocystis物种的验证的条目。所研究的现象所涉及的阶段或过程是根据生命周期模型来描述的。表1实验中带括号的首字母缩写出现在本节的小标题中。在四个案例研究中,给出了详细的方法和结果;在其他情况下,将根据已发表或提交的文献来源简要总结方法和结果,可咨询进一步的细节。讨论部分考虑了我们的经验Wndings对棕囊藻生命周期动力学本身的更广泛的影响,以及生命周期模型的潜在修订。
数据来源Whipple等人(2005b)这项研究
Nejstgaard等人(出版中)
Whipple等人(2005b)这项研究这项研究
这项研究这项研究
雅各布森等人(2005)
介观实验方法
下面讨论的许多观察和实验都是在挪威西部卑尔根大学海洋生物焊接站的挪威国家中观中心进行的中观研究的背景下进行的。研究在2002年3月4日至24日和2003年2月27日至4月2日之间进行(Nejstgaard et al. 2006);在本文的其余部分,这些研究将被称为2002年和2003年的中观研究。这些中观宇宙研究的主要结果将不会出现在这篇手稿中;Nejstg-aard等人(2006)详细提供了它们。本节的目的是提供关于介观研究的充分背景,以便在其背景下进行的实验能够被理解和解释。
在每项研究中,三个透明聚乙烯容器(4.5米深,2米直径,约11立方米,90% PAR)装满了未经过滤的峡湾水
袋囊假单胞菌菌落分裂的体外观察
从浅海峡湾沉积物中收集的粗糙表面物质中获得的集落的体外观察用硅藻锥柱从囊袋假单胞中集落形成的体外观察囊袋假单胞中集落生长的体外观察囊袋假单胞中集落细胞的体外观察球状假单胞和球状假单胞中集落细胞的差异基因表达实验确定球形假单胞对微小和介观浮游动物食草动物或对P. pouchetii 18S中菌落细胞释放的体外观察rDNA探针对2003年挪威介圈中生长的Phaeocystis物种的评估在5米深处对P. pouchetii完整和破坏的菌落的病毒感染和细胞裂解的体外观察。空运系统每天大约五次完全混合这些外壳。为了引入新物种,避免pH值变化,并替换取样时除去的水,每个围护区每天用峡湾水更新10%的水(Nejstgaard et al. 2006)。3个中尺度宇宙中有2个被硝酸盐和磷酸盐修饰,对应于初始富集16 |M硝酸盐和1 |M磷酸盐。每天添加16 |M硝酸盐和0.1 |M磷酸盐取代10%水更新和取样除去的营养物质。在2002年的实验中,根据3月12日测定的低营养物质浓度,在3月12日晚上,两个富含营养物质的介生境都增加了额外的营养物质,8 | M硝酸盐和0.5 | M磷酸盐。每个实验中的第三个中观,不作修改,作为对照(Nejstgaard et al. 2006)。Nejstgaard et al.(2006)详细描述了介观的建立、采样、分析方法和结果。
介生态系统的物种鉴定
在2002年和2003年的中观研究中,许多Phaeocystis群落被观察到完美的球形,这表明在挪威西部峡湾可能存在P. globosa而不是P. pouchetii。在第二次介观实验(2003年)中,研究人员努力确定这些介观研究中存在的棕囊藻物种的多样性。
方法
在2003年的研究中,每3天收集一次水(50500毫升),使用0.8 | m Supor®膜过滤器(Pall corp.),并在-80°C保存,直到分析。在对Phaeocystis sp.单细胞和菌落进行计数后,选择了两个样本进行Phaeocystis sp.群落组成的分子测定。Phaeocystis sp.小亚单位核糖体RNA (rRNA)基因序列分析,这些基因来自实验早期只有单细胞存在的受精围体样品(2003年3月5日;单细胞15ml -1,菌落0ml -1)和在花期高峰期采集的样品(2003年3月20日;单细胞990 ml-1,菌落41 ml-1)。如前所述,使用Ultra-clean™土壤DNA分离物(MoBio Laboratories, Inc.)从过滤器中提取总DNA (Allen et al. 2005)。利用通用18S rRNA靶向引物UnivF-15 (5' ctg cca gta gtc ata tgc;Frischer et al. 2002)和Phaeocystis属特异性引物PHAEO1 (5' cgg tcg agg tgg act cgt;Lange et al. 1996)。扩增反应使用应用生物系统9,700热循环器,体积为20毫升。 Each amplification reaction consisted of 8 ml Eppendorf ® MasterMix® (Eppendorf North America), 8.4 ml PCR grade distilled water, 3 ml each primer (100 ng ml-1), and 3 ml of undiluted or 1:10 diluted DNA extract. Purified DNA from the extracted samples was not quantified. Reaction conditions consisted of an initial denaturation step (94°C, 3 min) followed by 35 amplification cycles (94°C, 15 s; 53°C, 15 s; 72°C, 30 s) followed by a 7 min final extension at 72°C. PCR amplicons were examined on an agarose gel to insure that only a single band was produced. Single bands were cloned into the bacterial plasmid vector PCR®2.1 using the TOPO TA Cloning® kit (Invitrogen, Carlsbad, CA) and sequenced in both directions as previously described (Frischer et al. 2002).
结果
共对17个克隆进行了测序,每个克隆序列的身份都被证实为袋囊Phaeocystis pouchetii,这表明在这些研究中不太可能存在任何其他种类的Phaeocystis。
测试一个过程是否存在或生成一个过程的描述
底栖生物参与的菌落形成(CFBI)
底栖生物参与各种Phaeocystis物种的生命周期已在文献中讨论多年。凯瑟(1970)这样描述他在培养中对底栖细胞的观察:“有趣的是,袋囊Phaeocystis pouchetii的单细胞表现出一种附着在固体表面的倾向……我们可以假设,在公海中,单细胞附着在海底的固体表面或运动颗粒上,并不断地为自由水提供单细胞或年轻的菌落”(Kayser 1970, pp. 209-210)。卢梭等人(1994,第26页)总结道,存在“……绝对没有证据表明存在真正分化的底栖阶段。”
卢梭等人(在印刷中,这一卷)描述了P. globosa二倍体鞭毛虫附着在表面后一天内形成新的菌落(Cariou等人,1994;凯塞1970;Kornmann 1955;卢梭等人,1994)。无生命粒子(Rousseau et al. 1994),培养容器壁(Cariou et al. 1994;Kayser 1970)和硅藻(Weisse等人1986;Boalch 1987;Rousseau et al. 1994)被报道为粘附位点(Rousseau et al. in press, this volume)。细胞附着在表面导致了一个假设,即在自然环境中存在一个作为越冬形式的底栖阶段(Kayser 1970;卢梭等人在出版社,这卷)。 The general conclusion from these reports is that the diploid flagellate described in these studies is not a truly differentiated benthic form (Rousseau et al. in press, this volume).
在2003年的介观研究期间进行的经验工作测试了袋囊P. pochetii的单株细胞或菌落是否会从峡湾沉积物中重新悬浮,并在受控环境室中用过滤水进行培养。
方法
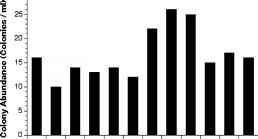
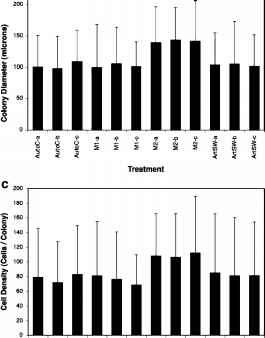
2003年3月14日,在挪威卑尔根附近的一个海岸海湾,由带壳和生物遗迹的中粒砂组成的底栖底物由潜水员在12米深的地方手工收集。在收集和实验准备期间,沉积物与上覆水保持隔离,并在孵育期间用过滤海水覆盖。在三个250毫升的PC瓶底部放置一组20毫升排干但潮湿的沉积物,并逐渐覆盖200毫升以下类型的水:人工海水;高压灭菌的峡湾水;0.8 ^m中膜1过滤水(对照:不添加营养物质);0.8 ^m过滤水来自2号介观(添加NO3和PO4)。这些瓶子在昏暗的光线下孵育(1.7 ^mol m-2 s-1,使用带有球形光收集器的Biospherical Instruments QSL-100仪表测量;12:12 L:D)在3°C的步入式冷藏室中,并在第0天(孵育开始)和第7天取样。用显微镜测量了囊袋假单胞菌菌落的丰度、直径和细胞密度。
结果
在孵育7天后,在所有的沉积物-水处理中都观察到袋状Phaeocystis pouchetii菌落(图2)。在装有中膜2 (M2)处理过滤水的瓶子中,菌落数量最多,这些处理每天都接受氮和磷的添加(图2a)。m2 -水样也含有最大直径的菌落,每个菌落的细胞数量最多(图2b,c)。
2002年,Whipple等人(2005b)通过对井板中观宇宙衍生的P. pouchetii菌落的体外观察,报告称1012%的井中含有至少分裂一次的菌落。他们还观察到,只有在经过许多小时后才观察到蜂群的分裂。这可能表明菌落在分裂产生子菌落之前,经历了一段通过细胞分裂和粘液产生的菌落扩大的时期(Whipple et al. 2005b)。这种集群繁殖模式在P. globosa中也有报道(Verity et al. 1988)。
区分单细胞和集落的分子标记的识别与Phaeocystis sp.的多形式生命周期相关的第一个假设生成问题是单个细胞和集落细胞之间的细胞和遗传差异的识别。为了在复杂的Phaeocystis生命周期的背景下开始解决这个问题,使用差分显示PCR方法来识别其表达在集落和单细胞中被调节的基因。这些研究的评分为30分
治疗
治疗b
治疗
图2浅层峡湾沉积物实验收集的表层物质结果。处理关键:ArtSW#:人工海水;autoc#:高压灭菌的峡湾水;M1- #: 0.8 |m过滤水从中观#1(=没有添加营养物质);M2- #: 0.8 |m过滤水来自中膜#2 (NO3和PO4添加)。(a)袋囊假单胞菌菌落丰度(菌落ml”1);直方图表示每个复制瓶的菌落估计。(b)菌落直径(|m);误差条表示由三次计数计算出的每个瓶子内估计的标准偏差。(c)细胞密度(细胞集落“1”); error bars represent standard deviations of estimates within each bottle calculated from triplicate counts
治疗
图2浅层峡湾沉积物实验收集的表层物质结果。处理关键:ArtSW#:人工海水;autoc#:高压灭菌的峡湾水;M1- #: 0.8 |m过滤水从中观#1(=没有添加营养物质);M2- #: 0.8 |m过滤水来自中膜#2 (NO3和PO4添加)。(a)袋囊假单胞菌菌落丰度(菌落ml”1);直方图表示每个复制瓶的菌落估计。(b)菌落直径(|m);误差条表示由三次计数计算出的每个瓶子内估计的标准偏差。(c)细胞密度(细胞集落“1”); error bars represent standard deviations of estimates within each bottle calculated from triplicate counts laboratory cultures of P. globosa (CCMP 1528, Provasoli-Guillard National Center for Culture of Marine Phytoplankton, USA).
方法
在L1-Si培养基中,在20°C、14:10明暗的条件下,培养三种独立的P. globosa CCMP 1528培养基一周(Guillard and hargraves, 1993)。在这些条件下,每一种培养都产生单细胞和菌落。用10 |m筛网和手动泵反渗透分离菌落中的单细胞。细胞和菌落分别收集到25mm, 5 |m Durapore过滤器(#SVLP02500, Millipore, Bedford, MA)。每个过滤器固定大约7.5 x 106个单细胞和5 x 104个小菌落(约1毫米)。使用Qiagen RNeasy Plant Mini Kit (Cat# 74903, Qiagen, Valencia, CA)按照制造商推荐的程序(Qiagen, Valencia, CA)从每个样品中提取RNA。结合每种培养物的复制样本的纯化RNA提取物(每种细胞类型6个提取物)。RNA使用RiboGreen (Molecular Probes, Inc.)荧光法定量,纯化的RNA储存在“80°C”下,直到分析。
使用Advantage®cDNA PCR试剂盒(Cat# K1905-1, Clontech Laboratories, Inc., Palo Alto, ca)从大约1 |g总RNA中合成cDNA,通过差异显示鉴定差异表达基因。使用与市售delta差分显示试剂盒®(Cat# K1810-1, Clontech Laboratories, Inc., Palo Alto, CA)相关的试剂和程序促进了差分显示分析。利用delta差分显示试剂盒中提供的10个任意25 mer引物(P引物)和9个Oligo(dT)引物(T引物)的90个独特组合完成cDNA扩增。差异显示扩增反应在20 |l体积中进行,使用2 |l 10X KlenTaq PCR反应缓冲液、14.2 | PCR级蒸馏水、0.2 | dNTP混合物(每个5 mM)、0.4 |l 50X Advantage®KlenTaq、0.2 | 33P dATP和1 |l 1:40或1:10稀释的cDNA模板。扩增条件为
表2球形假单胞伞菌落和单细胞差异表达基因片段
细胞类型部分调控完全调控波段——
up reg Down rega On Off
细胞1365 1193 32 32 117 16
殖民地1254 1193 7 7 7 15
一个Con,构成式表达;Up reg,上调的;下调reg,由Clontech推荐的下调,包括三个低严格PCR循环(第一个循环:94°C, 5 min;40°C, 5分钟;68°C, 5 min),第二次和第三次循环(94°C, 30 s;40°C, 30秒;68°C, 5分钟)和25个额外的高严格循环(94°C, 20秒;60°C, 30 s;68°C, 2分钟),然后在68°C中停留7分钟。扩增在专用的Amplitron热循环仪(Barnstead/ Thermolyne, Dubuque, IA)中进行。 Following confirmation of PCR amplification of cDNA by agarose gel electrophoresis, 5 ^l of PCR product was mixed with gel loading dye (2 ml 10x TAE, 7.5 ml 40% sucrose, 830 ^l 6x bromophenol blue, 100 ml distilled water) and 3 ^l was loaded onto a 7M urea, 6% acrylamide gel (553 x 381 x 4 mm) with 1x TBE buffer and electrophoretically separated at 1500V, 50W for 2.5-3 h. The gel was transferred to filter paper, covered with plastic wrap and dried on a vacuum gel dryer (Fisher Scientific, Pttsburgh, PA) for 1 h at 80°C. After drying, bands were detected by autoradiography in a film cassette with a 33P intensifying screen. Films were exposed for 4-6 days at -80°C. All bands were manually assigned into three primary categories; constitutively expressed, differentially expressed, or fully regulated. Bands categorized as constitutively expressed were those that appeared at approximately the same density in both colonial and single cells. Bands identified as differentially expressed were those whose autoradiographic density was substantially different between colonial and single cells. Fully regulated bands were those that were either present or absent in one cell type compared to the other.
在鉴定差异表达基因后,克隆并测序了7个存在于集落细胞中而不在单细胞中的基因。根据Clontech的建议,从干燥凝胶中切除差异表达的PCR带。简单地说,从凝胶/滤纸上剪下条带,放在40 ^l无DNase和rnase的水中,用两滴无菌矿物油覆盖,在100°C下加热5分钟。然后丢弃滤纸。用最初用于扩增感兴趣条带的相同引物重新扩增PCR产物。扩增后,在琼脂糖凝胶上检查PCR扩增物,以确保只产生一个条带。使用TOPO TA克隆®试剂盒(Invi-trogen, Carlsbad, CA)将单个条带克隆到细菌质粒载体PCR®2.1中,并使用先前描述的M13引物位点进行双向测序(Allen et al., 2005)。在使用Vector NTI Suite 8软件包(InforMax,贝斯-esda, MD)进行序列组装和编辑后,使用BLASTn和BLAST搜索几乎相同的短匹配来确定假定的基因身份(NCBI, http://www.ncbi.nih.gov)
结果
这些研究共观察到1365个来源于单细胞的表达基因片段和1254个来源于集落细胞的表达基因片段(表2)。在这些表达片段中,在单细胞中观察到117个在集落细胞中没有观察到的独特片段,在单细胞中检测到7个在集落细胞中表达而在单细胞中不存在的片段。在鞭毛细胞中观察到的172个差异表达基因中,与集落细胞相比,87%的差异表达基因(149个)上调或打开。相比之下,在集落细胞中观察到的61个差异表达基因中,只有23%(14)相对于单细胞上调或打开。
只在集落细胞中观察到的7个基因片段被克隆和测序,
表3球形假单胞菌菌落相关差异表达基因
克隆大小(bp) Genbank最近的爆炸命中身份登录号。基因库
预测函数接入号
PgC-3 490 bp DQ886384 AAP94719
PgC-10 342 bp DQ886385 ZP00777402
PgC-19 213 bp DQ886386 AY741371
PgC-13 384 bp DQ886387 XP639957
PgC-5 261 bp DQ886388 AF100332
DQ886389 AF107586
胡氏艾米丽娅NADH 4 × 10 14
脱氢酶亚基I udp -3-0-酰基1 × 10-37
n -乙酰氨基葡萄糖去乙酰化酶(细菌)赫胥黎艾米利亚菌CCMP 373 rRNA基因假设蛋白2 × 10-6
DDB01862282(Dictyostelium discoideum) Dendrobium grex Madame 6 × 10-5 thon - in假定的21D7蛋白(ovg29)
电子传递脂质组件
9 x 10-50蛋白质合成
类似于假定的应激反应蛋白Srg6
兰花花转化过程中的差异表达基因
这些基因片段的大小在213 ~ 490 bp之间,平均为362±114 bp。其中一个基因参与了细胞分裂,但没有产生可用的序列信息(表3)。在已知的基因中,有一个与能量产生(PgC-3)基因最相似,与烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶亚基i基因最相似。PgC-10与细菌的一个参与脂质组装的udp -3-0-酰基n -乙酰葡萄糖胺脱乙酰酶编码基因最相似,PgC-19与埃米iliania huxleyi的大亚基核糖体基因最相似。有趣的是,剩下的三个片段似乎与应激蛋白或与高等植物开花有关的基因有关。PgC-13最类似于变形虫Dictyostelium discoid-eum的一种假设的应激反应蛋白。PgC-5和PgC-6似乎都与兰花开花相关的基因有关。这些基因片段的序列已存入Genbank,登录号为DQ886384-9。
囊状假单胞菌(VIL)病毒易受病毒感染的生命阶段的确定以及囊状假单胞菌和球形假单胞菌的病毒感染和裂解过程的特征(Bratbak et al. 1998a, b;Brussaard et al. 2004,2005;雅各布森2000,2002;Jacobsen等,1996;
Veldhuis et al. 2005)。确定生命周期的哪些阶段容易受到病毒感染和裂解,对于了解病毒对Phaeocystis生命周期动力学和生态学的影响至关重要。大多数之前的工作与P. pouchetii (Bratbak et al. 1998b;哈姆等,1999;雅各布森2000;Jacobsen et al. 1996)和P. globosa (Brussaard et al. 2004;Brussaard et al. 2005)指出,孤立细胞易受病毒感染和裂解,而集落细胞则不易。然而,在一组实验中,Baudoux和Brussaard(2005)表明,定植的球形P. globosa细胞可以被PgV病毒感染。为了确定袋袋假单胞菌的哪些生命阶段易受病毒感染和裂解,Jacobsen等人(2005)在2003年的me - oscosm研究中进行了一组实验。在一组实验中,囊袋疟原虫孤立细胞与不同数量的病毒添加物和不含病毒的对照孵育(Jacobsen等,2005年)。 In a second set of experiments, colony cells that were detached from their colony matrix were incubated with different amounts of virus additions and a control containing no viruses; for comparison solitary flagellate cells were also included in this experiment. Colonies were shaken strongly in order to detach the cells from the mucus; this method is effective in producing colonial cells free of their mucus matrix because, in contrast to
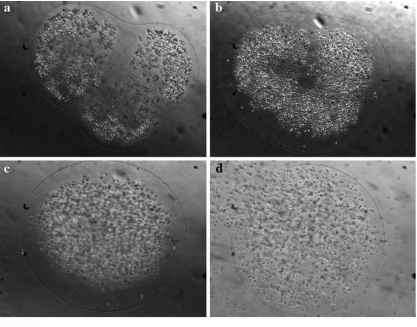
图3从2003年的介观生态系统中分离并维持在井板中的囊袋假单孢菌落的时间序列(见介观生态系统实验方法);数据格式:照片最长线性尺寸及日期时间(a) 880mm;2003年3月26日,11:33 (b) 920毫米;2003年3月27日,11:57 (c) 930毫米;2003年3月28日09:41 (d) 890毫米;2003年3月29日09:19;此时观察到菌落皮肤内和孔板内的细胞是活动的
P. globosa, P. pouchetii菌落容易破裂(Jacobsen et al. 2005)。
用病毒孵育的完整菌落没有病毒感染或裂解的证据(Jacobsen等,2005年)。在分离集落细胞的实验中,分离的集落细胞没有显示出细胞裂解的证据,而孤立的鞭毛细胞在实验期间完全裂解(Jacobsen et al. 2005)。
在P. pouchetii (CSWP;RCWP)在自然、中观和实验室条件下观察了Phaeocystis菌落的衰老(Davidson and Marchant 1992;兰斯洛特和卢梭1994;卢梭等,1994;Veldhuis等人,1986;Verity et al. 1988)。开花终止时,衰老菌落中的孤立细胞释放也有文献记载(Kornmann 1955;卢梭等,1994;Verity et al. 1988)。然而,对一般的菌落衰老和开花终止过程的详细了解很少。 In an in vitro study of P. pouchetii, colonies were isolated in well plates from the 2003 mesocosms, observed over a three-day period, and digital micrographs were taken to record colony morphology and measurement of dimensions.
在这项研究中,随着时间的推移,我们拍摄了一个单一的菌落,它显示了形态从典型的小叶袋囊P. pochetii形状变成球形的变化(图3a-d)。观察到形状变化所需的时间间隔为两天。在观察到形状变化大约一天后,观察到菌落包含活动细胞,并将一些细胞释放到培养基中(图3d)。虽然球形菌落可能是P. globosa,但我们在这些研究中没有发现P. globosa存在的证据(见本手稿中题为“meso - cosmos中的物种鉴定”部分)。需要进一步的研究来记录在其他情况下观察到的衰老现象,并严格描述和量化观察到的形态变化。
对过程或控制参数的量化或研究
工艺速率量化
Whipple et al. (2005b)报道了囊袋假单胞菌落的分离(CDWP)和生长(CGWP),在体外中胚层来源的囊袋假单胞菌落的分离率中值在第1天为0.21-0.28次。他们还发现这些菌落平均需要
3.5-4.9天完成一个分区;Cariou的培养数据(在Rousseau et al., 1994中描述)表明,P. globosa的菌落分裂发生在4-5天后,表明与P. pouchetii相似(Whipple et al. 2005b)。Whipple等人(2005b)报道,菌落的中位数增长率,以最大线性尺寸测量,范围从接近零到7 |m h-1。
控制参数
从孤立细胞到集落形态的转变是棕囊藻生命周期中的一个关键事件。许多花期主要由殖民地生命阶段组成(但参见Wassmann et al. 2005)。即使经过近一个世纪的研究,也没有确定从孤立细胞形成集落的必要条件。硅藻锥孔被认为是集落形成的粒子核,包括许多观察到的附着在硅藻锥孔刚毛上的小Phaeocystis集落(尤其是Chaetoceros) (Boalch 1987;兰斯洛特和卢梭1994;卢梭等人,1994)。卢梭等人(1994)指出“……在受控实验室条件下的实验工作(卢梭和戴维斯,未发表的数据)提供了强有力的证据,任何微观颗粒,无论是生物(如硅藻),有机或矿物(沙子,玻璃棉)都可以作为菌落发展的基质”(卢梭等人,1994,第35页)。Peperzak等人(2000b)认为,硅藻除了提供一种抵消局部乱流的底物外,还可能通过分泌维生素B1(一种可能的生长刺激物)或消耗维生素B12(一种假定的生长抑制剂)来影响菌落的形成。这些观察结果提出了硅藻锥孔可能促进菌落形成的假设。
在2002年的中观研究中,进行了一项实验,以确定在体外,向培养基中添加硅藻锥孔是否会提高P. pouchetii的集落形成率;详细的方法和结果见Nejstgaard et al. (in press)。集落形成率的估计使用了来自营养修正的介膜的水,该介膜被过滤以去除Phaeocystis集落,但允许单独的细胞通过。硅藻土被添加到处理井板的菌落中,而对照井板只接收过滤过的中观水(Nejstgaard et al. 2006)。在所有的实验中,新的菌落随着时间的推移近似线性地增加。过滤后中观水体的菌落形成速率为1.3 ~ 1.9个菌落ml-1 d-1;用硅藻土处理水的速率为2.6 ~ 2.8菌落ml-1 d-1。过滤水与硅藻土水的线性回归斜率显著不同(Nejstgaard et al. 2006)。Nejstgaard et al.(2006)的一般结论是硅藻土提高了P. pouchetii离体菌落形成率。
中浮游动物和微浮游动物对群落形成的信息化学效应。Long和他的同事们进行了一系列实验,以测试球形P. globosa的孤立细胞通过改变集落形成或集落大小来响应食草动物相关信号的能力。当球形P. globosa直接遇到微型浮游动物或中型浮游动物食草动物时,只有来自这些食草动物的化学信号,或没有食草动物的线索(Long 2004;Long et al.提交)。在最初的混合浮游动物实验中,三种优势食草动物是大小约1mm的tonsa Acartia tonsa和Pseudodiaptomus pelagicus成年桡足类和异养甲藻Noctiluca scintill -lans;球形P. globosa群落直径约50 |m。在其他试验中,单独使用tonsa和Euplotes spp.作为单独的放牧处理。
使用了两种类型的容器,它们都由膜隔开的连接隔间组成,并允许连接隔间之间进行化学交换,同时防止藻类和食草动物在隔间之间移动。在食草动物处理中,球形P. globosa细胞被添加到两个隔间中,而微型或中型浮游生物食草动物只被添加到一个隔间中。一组容器是1升的塑料瓶,去边,用强力胶覆盖Nitex网®(1 |m)。这些网孔瓶被放置在2升的玻璃烧杯中,允许在260平方厘米的网孔中进行化学交换。第二组容器被称为“通信室”,由两根0.64厘米厚的透明丙烯酸盖管(每根直径8.89厘米,长度约7.94厘米,每根最终容量为500毫升)组成,它们相互旋进,并用0.8 | m聚碳酸酯膜过滤器隔开(Long 2004;Long等人,已提交)。
在放牧处理中,在两个隔室中都添加球形棕囊藻细胞,而在一个隔室中只添加放牧动物细胞。这允许同时评估与无食草动物对照相比,食草动物对菌落形成的直接和间接影响(Long 2004;Long等人,已提交)。为了加强实验室之间的化学信号交换,网格瓶被放置在台式轨道激振器中,并以50转/分钟的速度旋转;每个瓶子也每天轻轻抬起两次,直到它的一半体积从一个室移到另一个室(Long 2004;Long等人,已提交)。关于实验设置、采样方法和结果的更多细节可以在Long(2004)和Long et al.(已提交)中找到。
在最初的混合浮游动物实验中,Long et al.(提交)发现甲壳纲中浮游动物,以成年桡足类A. tonsa和P. pelagicus为主,显著抑制菌落形成。在其他实验中,Long等人(提交)发现,仅从介浮游动物a.t onsa获得的信息化学线索就抑制了菌落的形成。Long等(已提交)也观察到tonsa的群体抑制效果具有密度依赖性。在微型浮游动物Euplotes spp.的实验中,Long等人(已提交)报告说,来自这种纤毛虫的信息化学线索促进了球形P.的集落形成。
讨论
单细胞向菌落的转化
硅藻茎叶在体外能促进袋囊P. pochetii菌落的形成(Nejstgaard et al. 2006),因此,这一过程可能会加速孤立的活动细胞原位转化为新的菌落。这是形成以菌落为基础的Phaeocystis blossom的关键步骤,因此在构建Phaeocystis定量生态系统模型中至关重要。未来的研究必须详细阐述硅藻锥孔对菌落形成率的控制,如剂量反应、物种差异(Phaeocystis或硅藻),以及这种控制在开花过程中如何变化。这些结果可以在机制模型中表示的一种方法是包括集落形成率算法,该算法可以根据Phaeocystis环境中硅藻锥孔的密度改变集落形成率。
化学线索实验的结果指出了消费生物在影响Phaeocystis生命周期中的潜在重要作用。Tang(2003)发现,浮游微动物的放牧导致了群落生命阶段细胞比例的增加,并增加了群落的平均大小;Long等人(已提交)还发现,来自纤毛虫(euplo -otes spp.)的信息化学线索促进了球形P. globosa的集落形成。相比之下,Long等人(提交)发现来自中型浮游动物tonsa Acartia tonsa的化学信号抑制了P. globosa的菌落形成。由于观察到中观和微浮游动物食草动物的不同反应,Long等人(提交)假设球形P. globosa可能能够探测放牧,识别食草动物类型,并通过增强或抑制群落的形成或现有群落的生长来响应。Phaeocystis的这种诱导反应意味着菌落形成的复杂控制机制,其中化学信号被接收、处理,并根据信号中包含的信息做出反应。进一步的经验工作可能包括识别信号中的化学物质,以及确定食草类群信号的特异性。Tang(2003)和Long等人(已提交)的研究结果允许将控制结构添加到包括检测食草动物、识别发送者以及Phaeocystis孤立细胞或菌落对食草动物的适当反应在内的机制模型中。此外,Long等人(提交的)的研究结果表明,a . tonsa的群体抑制效果依赖于密度,这为在含有Phaeocystis生命周期阶段的浮游生物模型中产生这些食草动物衍生的信息化学物质的影响的剂量响应算法提供了第一个数据。这类控制证明了生物符号学在生态系统模型中可以产生的生物复杂性的一个方面。
实验结果表明,从浅层峡湾沉积物中收集的粗糙表面材料表明,底栖生物颗粒可能是菌落形成的场所。在孵育期间出现在上覆水中的菌落来自与沉积物相关的细胞或非常小的菌落。由此推测,这些细胞或小菌落与这些沉积物自然共生,但不排除它们在采集时被人为混合到沉积物中的可能性。这些研究的目的不是为了证明或否定真正的底栖生物生命周期阶段的发生或存在,它自最初的假设存在以来一直没有被发现(Kornmann 1955;凯塞1970)。更确切地说,最朴素的解释是,这些粗糙的沉积物充当了新菌落形成的附着点,非常像水柱中的硅藻和硅藻锥孔(Rousseau et al. 1994;雅各布森2002;Nejstgaard et al. 2006)。在整个中观宇宙研究期间,峡湾中都存在蜂群(Nejstgaard et al. 2006)。这些结果表明,在棕囊藻集落生长期间,光照水域下的浅层沉积物可能是集落形成的场所。 The ecological contribution of colonies derived from such a mechanism must await a thorough seasonal study that includes sampling before and after the period of colony appearance in the water column. This Wnding suggests that some form of benthic involvement should be included in Phaeocystis life cycle models; these experiments do not provide evidence for a distinct benthic life cycle stage of P. pouch-etii. Mechanisms that provide for benthic sediments providing colony formation sites could be provisionally included in models of Phaeocystis life cycles. Empirical studies to provide details of these sediment mechanisms are required to further elaborate conceptual or mechanistic models.
比较单个和集落Phaeocystis细胞之间的基因表达proWles表明,在单期生命周期阶段表达的基因比在集落生命周期阶段表达的基因更多,这意味着与单细胞相关的生化复杂性增加。虽然作为这些研究的一部分进行的差异显示分析绝不能代表集落和单细胞生命周期之间分子差异的全面表征,但有趣的是,在集落Phaeocystis细胞中表达的几个基因,而不是在鞭毛单细胞中表达的基因,似乎与高等植物的胁迫、细胞信号转导和复杂的发育转变有关。此外,在Phaeocystis中,除了密切相关的happhyphyte Emiliania huxleyi之外,还存在与系统发育多样化的生物(包括细菌、变形虫和高等植物)密切相关的基因,这表明Phaeocystis的基因组可能由复杂的基因镶嵌和调控元件组成,类似于其他微藻,包括硅藻,其基因组最近已被完全测序(Montsant et al. 2005)。
本文所述的研究也证明了未来Phaeocystis sp.对基因组和转录组学研究的适应性。只需要相对较少的修改,就可以改造市售的RNA纯化试剂盒,用于植物细胞,以产生适合构建来自球形Phaeocystis globosa单细胞和集落的cDNA文库的RNA。先前的几份报告表明,适合分子研究的基因组和质体DNA也相对容易地从各种Phaeocystis物种中获得(Zingone et al. 1999;Lange et al. 2002)。正如生物学的所有领域所发生的那样,从单个生物和生物群落获取分子信息,对生物体的生理学、生活史和生态学(包括可获得分子信息的微藻)产生了巨大的见解(Allen 2005, Walker et al. 2005)。毫无疑问,当完整的基因组和全面的基因表达数据获得时,将获得对Phaeocystis生活史的重要新见解。
殖民地扩散
体外集落分裂的文件提供了证据,两种类型的集落增殖袋P.。首先,菌落可以由孤立的细胞形成,并通过有丝分裂和细胞外粘液的分泌生长,形成大多数花中观察到的大菌落。关于P. globosa (Rousseau et al. 1990)和P. pouchetii (Verity et al. in press)的细胞数量与生物量之间的关系已经有文献记载;这些数据将提高袋囊假单胞菌菌落大小测量的有用性。其次,现有菌落可能发生分裂,分裂后还可能通过有丝分裂和细胞外黏液的分泌而增大(Whipple et al. 2005b)。后一种途径使菌落的数量比所有菌落都由单独细胞产生时增加得更快,因为由菌落分裂产生的子菌落一开始有数百个细胞,并且可能比用单独细胞建立的菌落更快地达到较大的规模。由于集落分裂的可能性,由孤立细胞形成的集落构成了一个源群体,通过连续的集落生长和集落分裂阶段,可以衍生出大量的多细胞集落。对这种集落增殖模式进行建模可以深入了解其对Phaeocystis bloom动态的可能影响。需要进一步的工作来确定这种模式在自然Phaeocystis开花中观察到的程度。
菌落衰老和单细胞释放
通过对球形菌落的观察和遗传数据的支持,高可信度地将其确定为袋囊假单胞菌,这表明仅通过菌落形状就可以用其他方法来明确识别在野外观察到的Phaeocystis菌落的种类。在体外观察到的囊袋假单胞菌菌落形态变化表明,在菌落衰老过程中,菌落细胞活动和生理可能发生了许多变化,从而导致了这种形态变化。目前还不清楚蜂群细胞在衰老过程中发生了什么变化;然而,这种菌落形状的变化观测指出了一个可能发生重大变化的时期。进一步研究在这一形状变化期间的集落细胞特征可能会进一步深入了解P。
pouchetii。这些结果所描述的定性形状变化不能有效地纳入Phaeocystis生命周期模型;然而,如果通过对这一集落阶段的进一步研究发现衰老过程中的细胞生理学细节,它们可能对模型开发有用。
菌落或孤立细胞损失:病毒感染和裂解
如果花主要是由菌落形成的,囊状假单胞菌可以通过形成菌落来逃避病毒裂解。直到菌落经历衰老并释放出孤立的鞭毛细胞,这将被预测为易受病毒感染,袋囊P. pochetii菌落细胞将被保护免受病毒感染。透明外聚物颗粒(TEP)似乎可以结合病毒(Brussaard et al. 2005),引入了另一种控制,这可能在开花结束时Phaeo-cystis菌落的衰老过程中特别重要。
Jacobsen等人(2005)报道,囊袋假单胞菌分离的菌落细胞似乎不可感染。这表明,集落细胞可能具有或获得了一些不涉及集落被膜的固有的病毒感染抗性。因为分离的菌落被含有TEP的菌落粘液所包围,PgV颗粒可能已经与TEP结合,降低了它们感染分离细胞的能力。这一潜在的混杂因素应在今后的实验中加以解决。Jacobsen(2002)提出,菌落被膜孔洞小到无法容纳病毒颗粒可能是防止病毒感染菌落的一种机制。Jacobsen et al.(2005)报道的结果表明,另一种机制可能是P. pouch-etii缺乏集落细胞裂解的原因。这些实验并不是为了阐明具体的病毒感染机制,需要进一步的研究来证实这些初步观察和研究裂解耐药的机制(Jacobsen et al., 2005)。Ruardij等人(2005)将病毒裂解纳入球形假单胞菌的模拟模型;如果Jacobsen等人(2005)的结果被纳入袋囊假单胞菌的模拟模型,病毒裂解只涉及孤立细胞,一旦细胞处于集落形态,它们将对病毒无坚不摧。
总结与结论
Whipple等人(2005a)对包括在其中的几个部门、流程流及其控制进行了实证研究,以填补我们理解中的空白。概念模型涉及两个主要方面。
第一个涉及到测试生命周期过程是否存在或生成这样一个过程的描述。这里讨论的五个例子包括(a)在P. pouchetii (CDWP)中的体外菌落分裂的演示;(b)与衰老相关的P. pouchetii离体菌落形状变化的描述(CSWP);(c)确定袋袋假单胞菌的哪个生命阶段(单细胞或菌落)易受病毒感染和裂解(VIL);(d)证明底栖生物可能参与袋氏囊藻的生命周期;(e)球形P. globosa (DGE)孤立细胞与集落细胞的差异基因表达。
第二个方面涉及流程或监管控制的量化。囊袋假单胞菌过程速率量化的两个例子是:(a)体外菌落分裂率(CDWP)和(b)体外菌落生长速率(CGWP)。还有两个调查过程控制的例子。二是浮游中栖食草动物释放的信息化学物质和浮游微栖食草动物释放的信息化学物质对球形P. globosa的集落形成有抑制作用。
在Phaeocystis生命周期模型的背景下研究Phaeocystis生态学的这些特征的意义在于,新的见解和理解很容易容纳在已经建立的事实和假设的已有组织方案中。生命周期模型使这种新的认识具有连贯性,可以改进生态系统模拟模型(例如,Canziani和hallam 1996;维里蒂2000;兰斯洛特等人,2005;Ruardij et al. 2005)设计用于接收生命周期信息,并将其与更广泛的生态系统联系起来。从这个角度来看,Phaeocystis是一个复杂适应系统(CAS)的明确例子(Waldrop 1992;Kauffman 1993, 1995)被纳入更广泛的生态系统,也被视为一个复杂的适应系统。使用概念或生态系统模型来推动实证研究,然后将其纳入新的模型结构,最终可以更好地洞察棕囊藻种群对全球生物地球化学循环等重要当代问题的直接和间接影响,并阐明棕囊藻在其有组织的生态系统中的作用。
作者要感谢卑尔根大学海洋生物站的T. Sorlie, A. Aadnesen和H. Gjertsen在介宇宙实验期间提供的帮助。我们感谢斯基德威海洋研究所的现任和前任工作人员:M. Zirbel, T. Walters, J. Danforth, K. Kohlberg, G. Smalley, D. Heaton, J. Brofft和R. Hristov。我们还要感谢佐治亚理工学院的现任和前任学生和教师:T. Barsby和M. Hay。由美国国家科学基金会拨款0PP-00-83381资助。本文是对SCOR工作组120“Phaeocystis,气候相关元素生化循环的主要环节”的贡献。raybet雷竞技最新
参考文献
艾伦AE(2005)揭示了海洋硅藻在多变环境条件下能量平衡的分子基础。杨晓明,王晓明,王晓明,等(2005)巴伦支海水体硝酸盐含量对硝酸盐同化基因的影响。生态学报(自然科学版)Aquat Microb Ecol 39:247-255 Ayers GP, Gillett RW (2000) DMS及其在遥远海洋大气中的氧化产物。海洋决议43:275-286
鲍杜A-C,布鲁萨德CPD(2005)感染海洋有害藻华物种球形棕囊藻的不同病毒的特征。病毒学341:80-90 Boalch GT(1987)最近在英吉利海峡西部开花。拉普P-v Reun Cons int explorer Mer 187:9497
王志强,王志强,王志强,等(1998a)囊性褐囊藻病毒裂解与细菌次生生产。王志刚,王志刚,王志刚,王志刚(2008b)囊袋Phaeocystis pouchetii病毒的产生及其与宿主细胞生长和营养的关系。杨晓东,李志强,李志强(2005)球形棕囊藻(Phaeocystis globosa)种群动态的多群体研究。病毒在水花控制中的调控作用。布鲁萨德CPD, Short SM, Frederickson CM, Suttle CA(2004)感染浮游植物球形Phaeocystis globosa (Prymnesiophyseae)的新型病毒的分离和系统发育分析。应用环境微生物70:3700-3705
李志强,李志强(1996)以褐囊藻为主导的浮游生物群落动态的数学模型。一、基本模型非线性世界3:19-76
李志刚,李志刚,李志刚(1994)棕囊藻群落的形成。J Plankton Res 16:458470
李志强,李志强(1992)棕囊藻(Phaeocystis)的生物学和生态学研究。在:圆FE,查普曼DJ(编)在心理学研究的进展。Eilertsen HC (1989) Phaeocystis pouchetii (Hariot) Lagerheim,北极海洋生态系统中的一个关键物种:生活史和生理学。Rapp P-v Reun Cons int explor Mer 188:131 Frischer ME, Hansen AS, Wyllie JA, Wimbush J, Murray J, Nierzwicki-Bauer SA(2002)浮游生物样本中18S rRNA基因特异性扩增检测斑马贻贝(Dreissena polymorpha)幼虫的方法。Gabric AJ, Matrai PA, Vernet M(1999)巴伦支海春季藻华期间二甲基硫化物生成的模拟。Tellus Ser B Chem Phys Meteorol 51:19 -937
Guillard RRL, Hargraves PE(1993)固定藻是一种硅藻,不是一种菊花植物。Phycologia 32:234236
Hamm CE, Simson DA, Merkel R, smemetacek V(1999)球形Phaeocystis globosa的菌落被一层薄而坚韧的皮肤保护。Jacobsen A(2000)挪威水域Phaeoc雷竞技csgoystis pouchetii (Haptophyta)开花动态的新方面。博士学位论文。渔业和海洋生物学系(45页)。雅可布森A(2002)袋囊Phaeocystis pouchetii (prm -nesiophyceae)的形态、相对DNA含量和假设生命周期;特别强调鞭毛细胞类型。王志强,王志强,王志强,等(1996)一种感染袋状褐囊藻的病毒的分离与鉴定。杨晓东,杨晓东,杨晓东,杨晓东,等(2005)软囊Phaoecystis pouchetii (Prymnesiophyceae)对病毒感染的敏感性?美国湖沼与海洋学学会夏季会议。ASLO,圣地亚哥德孔波斯特拉,西班牙考夫曼SA(1993)秩序的起源。 Self-organization and selection in evolution. Oxford University Press, New York Kauffman SA (1995) At home in the Universe. The search for laws of self-organization and complexity. Oxford University Press, New York
Kayser H(1970)袋褐囊藻(Haptophyceae)的实验生态学研究。Kornmann PV (1955) Beobachtungen an Phaeocystis-
Kulturen。Helgol wiss Meeresunters 5:18 -233 Lancelot C, Keller MD, Rousseau V, Smith WO, Mathot S(1998)海洋happhyte Phaeocystis sp. In: Anderson DM, Cembella AD, Hallegraeff GM (eds)有害藻华的生理生态学。兰斯洛特C,卢梭V (1994) Phaeocystis的生态学:菌落形式的关键作用。在:Green JC, Leadbeater BSC(编)的happhyte藻类。Lancelot C, Spitz Y, Gypens N, Ruddick K, Becquevort S, Rousseau V, Lacroix G, Billen G(2005)北海南部海湾硅藻和Phaeocystis开花和养分循环的模拟:MIRO模型。李文杰,王志强,王志强(2001)中国生态科学与工程学报(自然科学版)
ocystis-dominated生态系统。陈永强,陈永强,陈志明(2002)利用编码区和非编码区对棕囊藻(prymnesioph -ceae)进行分子遗传划分。王志刚,王志刚,王志刚,王志刚,等(1996)利用核糖体rna靶向核酸探针鉴定假囊藻属和Prymnesiophyceae。龙JD(2004)海洋中消费者-猎物相互作用的可塑性:化学信号、习得性厌恶和生态后果。博士学位论文。生物系(119页)。乔治亚理工学院,美国佐治亚州亚特兰大。网址链接:http://www.etd.ga-tech.edu/theses/available/etd-11182雷竞技csgo004-164652/unre-stricted/long_jeremy_d_200412_phd.pdf Long JD, Smalley GW, Barsby T, Anderson JT和Hay ME(已提交)化学线索在b中诱导消费者特定防御
这篇文章有用吗?