Phaeocystis开花过程中DOM释放的机制
一般有10-25%的浮游植物初级生产是DOC(夏普1977;拉尔森和哈格斯特罗姆1979;Lignell 1990;Teira et al. 2003;Maranon et al. 2004)。DOM产生的三个主要机制是:(1)细胞裂解后释放,例如,由于病毒感染、浮游动物随意摄食和排出,(2)细菌裂解胞外多糖(Smith et al. 1995),或(3)作为完整细胞的生理过程直接释放(Nagata 2000综述)。DOM产生的两种生理机制被提倡:小代谢物通过细胞膜的被动扩散(Bj0rnsen 1988)和溢出机制,即当C固定率超过大分子产生率时,多余的光合产物被主动释放(Fogg 1983)。
在Phaeocystis bloom的指数生长阶段,由于非生理过程导致的DOM释放将是低的。在球形假单胞藻中,细胞裂解率在生长期较低(Van Boekel et al. 1992;Brussaard et al. 1995,1996,2005a),因此细胞裂解导致的DOM释放将是不显著的。由于Phaeocystis菌落大部分逃脱放牧控制(Breteler和Koski 2003;Nejstgaard et al. 2007),草率的喂食也不会导致DOM的大量释放。在硅藻爆发中,细菌定植了健康、活跃生长的毛毛藻和Tha-lassiosira细胞,具有高外酶活性。当浮游植物表面物质被细菌水解的速率超过吸收速率时,DOM就会释放到环境中(Smith et al. 1995)。虽然P. globosa开花的生长阶段通常伴随着细菌数量、细菌产量和酶活性的增加(Billen和Fontigny 1987;Van Boekel等,1992;Putt et al. 1994; Becquevort et al. 1998; Arrieta and Herndl 2002; Brussaard et al. 1996, 2005b), young healthy colonies are generally free of bacteria (Thingstad and Billen 1994; Lancelot and Rousseau 1994). Therefore, it is unlikely that hydrolysis of the mucous matrix by bacteria will lead to significant DOM production during the growth phase of the bloom. The only significant mechanisms for DOM production is probably direct release of DOM from healthy cells. During all growth stages DOM excretion from healthy cells was observed in cultures of Phaeocystis sp. (Biddanda and Benner 1997). Since DOM excretion rates are low (see above) on the whole DOM release during the growth phase of the bloom will be low.
然而,在开花的固定阶段,DOM释放增加。在静止阶段,集落被破坏,鞭毛细胞在集落内发育(Pe-perzak et al. 2000)。由于粘多糖和葡聚糖的溢出生产,碳水化合物- c与POC的比例增加。在开花的这一阶段,通过非生理过程产生的DOM会很高。在P. globosa开花的高峰期,观察到细胞裂解率高达33% (Van Boekel et al. 1992;Brussaard et al. 1995,1996,2005a)。这样,富含碳水化合物的细胞内容被释放为DOM。当在集落内发育的鞭毛细胞脱离集落基质时,它们很容易被浮游微动物啃食(Weisse和Scheffel-Moser 1990;Tang et al. 2001)。这导致浮游微动物排出DOM。 During the stationary phase of a bloom, bacterial communities attach to Phaeocystis colonies and to ghost colonies. Bacteria with high glucosidase activity are present in both free-living and particle-attached communities (Billen and Fontigny 1987; Becquevort et al. 1998). If hydrolysis rates of mucopolysac-charides from the colony matrix exceeds uptake of the sugars, the sugars and oligomers derived from mucopolysaccharides may be released as DOM.
在褐囊藻中未观察到营养限制下DOM的过量释放。在Phaeocystis sp.培养物中,DOC的产生与POC的产生在不同的生长阶段是耦合的(Biddanda和Benner 1997)。同样在P. antarctica的圈地中,在养分耗尽后,最近产生的DOC的比例仅略有增加(Smith et al. 1998;Carlson et al. 1998)。这表明,营养限制不会导致溢出机制导致DOM排泄增加。
棕囊藻碳水化合物形成水凝胶
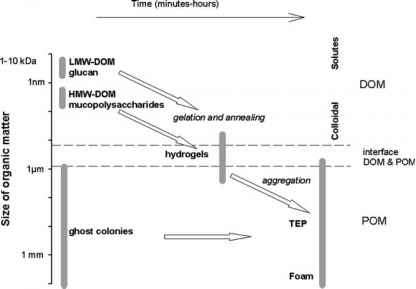
多糖在水环境中可以自发地组装成水凝胶。然后,这些聚合物凝胶可以穿透邻近的凝胶,并将它们退火在一起,增加尺寸谱。最近的发现强调了聚合物凝胶在有机碳生物地球化学循环中的重要性(参见Verdugo et al. 2004年的综述)。如上所述,粘多糖在水溶液中自发形成聚离子凝胶。除了凝胶的形成通过粘多糖,b-1,3-葡聚糖也已知在水溶液中形成非离子凝胶(Renn 1997;Kim et al. 2000)。一般来说,b-葡聚糖的凝胶性质取决于分子的浓度、大小、一级和二级结构以及温度(Bohm和Kulicke 1999;Lazaridou et al. 2003)。因此,海藻素在海洋环境中的成胶特性很难预测。我们实验室的初步结果表明,海藻素溶解在海水中会导致粘度增加,但据我们所知,还没有对此进行进一步的研究。Seuront等人(2007)表明,相囊藻衍生的聚合物物质可以增加海水粘度高达两个数量级。由于葡聚糖和粘多糖都具有很高的聚集潜力,Phaeo-cystis藻华衰老过程中释放的碳水化合物可能会导致海水粘度的增加(图2),从而改变细菌所遇到的有机物的物理性质和微观结构。
凝胶提供了一种非生物载体,将有机分子的尺寸范围扩大到能够沉淀的尺寸,并且还可能构成形成Phaeocystis开花后经常观察到的泡沫的中间物(图2)。大的凝胶颗粒,也称为透明外聚物颗粒(TEP),可以显著促进沉淀过程。这可能是直接沉积造成的(Wassmann et al. 1990;Riebesell等,1995;Hong等人,1997年),或者像胶水一样,将开花期间出现的有机物粘在一起,从而增强它们对垂直通量的贡献(Passow和Wassmann 1994年)。Mari et al.(2005)研究表明,在N和P限制条件下生产的TEP的性质是不同的,这可能会影响有机质的输出与保留平衡。这是诱人的推测,不同的N/P比可能决定溢出代谢是否指向葡聚糖或粘多糖的生产。这类似于硅藻圆筒叶形藻的情况,与n限制相比,P消耗导致杂多糖与葡聚糖的比例增加(Magaletti et al. 2004)。这样,葡聚糖/粘多糖的比例可能会影响水凝胶和TEP的性质
图2从不同的Phaeocystis有机物质池中形成海洋凝胶的概念表示(继Verdugo et al. 2004)。(简称:LMW-DOM:低分子DOM, HMW-DOM:高分子DOM, POM:颗粒有机质,TEP:透明外聚物颗粒)
形成,从而降解棕囊藻有机物的潜力。
继续阅读:微生物降解
这篇文章有用吗?