微生物降解
一般来说,Phaeocystis开花产生的大部分生物量在水柱中被异养细菌再矿化(Wassmann 1994, Rousseau et al. 2000)。然而,偶尔也有DOM和泡沫堆积的报道(例如Eberlein et al. 1985;兰斯洛特等人,1987;Seuront et al., 2007)。这似乎表明,细菌降解的有机物质产生的棕囊藻开花不同的开花,有时是受阻的。退化缓慢可能有各种原因,在开花的不同阶段可能有所不同。
棕囊藻碳水化合物的微生物降解
在P. antarctica开花的生长阶段,发现所有产生的DOM都被细菌迅速降解(Smith et al. 1998)。然而,随着时间的推移,细菌可利用的有机物的组成和贡献将从生长期易降解的新鲜排出的DOM转变为衰老阶段以粘多糖和葡聚糖为主的DOM。在实验室实验中表明,来自P. globosa和P. pouchetii菌落的碳水化合物在缺氧和缺氧条件下都容易被细菌群落降解缺氧条件下(Osinga et al. 1997;Janse et al. 1999)。葡聚糖的降解率高于粘多糖(Osinga et al. 1997),但在降解粘多糖的过程中,粘多糖的糖组成保持不变。因此,在粘多糖部分中没有难解部分的迹象(Janse等,1999年)。
对培养物中参与黏液-多糖降解的细菌的鉴定和介体显示了来自不同系统发育类群的细菌的存在,如-变形菌门和y-变形菌门、拟杆菌门的嗜细胞-黄杆菌(CF)类群和浮游细菌和疣微生物类群(Janse et al. 2000;Brussaard等,2005b;Alderkamp等2006b)。在中观世界的球形P. blobosa开花期间,细菌群落随时间呈现明显变化(Brussaard et al. 2005b)。浮游植物生长控制基质的性质(即N或P)不影响微生物群落。此外,由于粘多糖降解过程中细菌群落的物种组成保持不变,因此粘多糖的降解本身并不需要物种演替(Janse et al. 2000)。因此,微生物群落的变化很可能是由球藻开花的生长期和衰老阶段细胞裂解增强以及DOM的释放引起的(Brussaard et al. 2005b)。聚合物的降解需要专门的细胞外酶系统来水解聚合物,然后再被细菌吸收。这些酶可以附着在细菌细胞上(胞外酶),或游离的胞外酶(Chrost 1991)。Arrieta和Herndl(2002)揭示了在P. globosa开花期间,一系列不同类型的细菌b-葡萄糖苷酶,这与细菌群落的变化有关。 Therefore, the copious amounts of glucan and mucopolysaccharides produced during a Phaeocystis bloom may shape the composition of bacterial communities specialized in degradation of complex carbohydrates. Bacteria appearing during the senescent stage of the P. globosa bloom in the mesocosm mainly belonged to the a-Proteobacteria and CF cluster of the Bacteroidetes (Brussaard et al. 2005b). In the coastal North Sea, bacteria from CF clusters of the Bacteroidetes were dominant during and following a bloom of P. globosa (A. C. Alder-kamp et al. 2006b). Members of the CF cluster are chemo-organotrophic, and known for their capacity to degrade complex carbohydrates such as pectin, cellulose and chitin (Reichenbach and Dworkin 1991; Cottrell and Kirchman 2000; Kirchman 2002). Therefore, it may be that certain taxa of this cluster have adapted specifically to degradation of complex mucopolysaccharides produced by Phaeocystis.
微生物降解的矿物养分限制被提出,作为Phae-ocystis开花后富碳DOM积累的解释(Thingstad and Billen 1994)。由于溢出代谢,碳水化合物/POC的增加将产生对细菌不利的C/P和C/N比的底物。由于细菌的C/P比可能大大低于浮游植物(Vadstein et al. 1988),特别是磷酸盐限制可能阻碍微生物降解(Thingstad et al. 1988)。
1997)。此外,由于P. antarctica被发现每摩尔磷酸盐比硅藻去除更多的二氧化碳(Arrigo et al. 1999),细菌降解Phaeocystis材料时的磷酸盐限制可能比降解硅藻材料时更严重。事实上,尽管在球形假单胞菌开花的生长阶段,细菌的生长受到碳的限制,但在开花结束时葡聚糖和粘多糖的大量释放期间,细菌的生长受到碳和磷酸盐的限制(Kuipers和Van Noort,在准备阶段)。这可能会阻碍原本容易降解的碳水化合物的降解,并延长降解时间。
水凝胶的微生物降解
海洋凝胶可能对有机物的微生物降解有影响,但很少有研究直接检验了这种影响。基于目前的知识,凝胶的形成可增强或减缓有机物的降解。一般来说,hmm - doc和凝胶比lmm - doc具有更高的生物降解率和周转率(Amon和Benner 1996)。凝胶可以作为营养物和/或附着表面,并为细菌提供高底物浓度的热点。它们形成封闭的底物微环境,供细菌定植,释放细胞外酶,并在局部高浓度下有效地吸收降解产物(Azam 1998;Azam and Long 2001)。事实上,随着球形P. blobsa颗粒附着的细菌比自由生活的群落更活跃(Becquevort et al。
1998)。另一方面,将自由聚合物组装成凝胶可能会使降解复杂化。
形成不溶性凝胶的碳水化合物的酶降解速度大约比由相同单体键组成的聚合物的降解速度慢50倍,但不能形成凝胶(Alderkamp et al. 2007)。如果这种差异是“自由”聚合物和嵌入凝胶中的聚合物降解潜力差异的典型例子,那么周转时间可能会从几天减慢到几年。
当水解速率超过细菌的碳需求时,微生物降解溶解水凝胶,从而从水凝胶中释放出LMW产物(Smith et al. 1992;此外,细菌酶系统的动力学特性可能导致低聚物的释放速率高于可被细菌直接结合的单体的释放速率,从而释放出低分子量和中分子量(MMW)的产物(Alderkamp et al. 2007)。此外,紫外线照射下的聚合物光裂解可以缩短聚合物链,使纠结的网络不稳定(Edwards 1986),并且可以很容易地分散海洋聚合物凝胶基质(Orellana和Verdugo 2003)。这三个过程产生随机碎片,产生易于被细菌吸收和代谢的LMW产物(Mopper et al. 1991;Moran和Zepp 1997;Mopper和Kieber 2001),增加了水凝胶中有机物的快速降解。另一方面,释放出来的聚合物可能太大,细菌无法运输,但又太小,无法组装成稳定的网络,细菌可以定植并有效地用细胞外酶降解。这些聚合物,如图3所示为DOM (MMW-DOM),可能有助于难熔DOM的形成。
细菌活性也可能增加凝胶的聚集(图3)。对细菌外聚物生产的研究表明,相当一部分同化碳被并入外聚物囊膜(Stoderegger和Herndl 1998)。这些囊状外聚物增加了浮游植物和其他颗粒的聚集概率,并作为已经存在的聚集物的稳定剂(Allison和Sutherland 1987;Decho 1990;Heissenberger and Her-ndl 1994)。此外,细菌外聚物
图3改变有机物大小和顽固性的生物和非生物过程的概念表示。(简称图1,MMW-DOM:中分子量DOM)
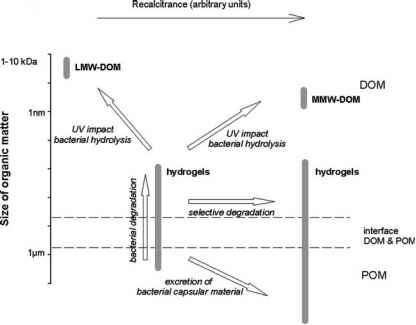
抗细菌酶降解,因为相当一部分细菌胞外酶嵌入在外聚聚合物胶囊中。因此,细菌衍生的外聚物的释放降低了水凝胶的降解潜力。最后,对易降解化合物的选择性降解可能会改变凝胶的组成,并降低剩余凝胶的降解潜力(San-nigrahi et al. 2005)。目前尚不清楚上述机制在多大程度上影响水凝胶的微生物降解。因此,水凝胶的形成可能会促进或阻碍Phaeocystis衍生DOM的微生物降解。
继续阅读:材料与方法
这篇文章有用吗?