棕囊藻及其与病毒的相互作用
Corina P. D. Brussaard•Gunnar Bratbak•Anne-Claire Baudoux•Piet Ruardij
收稿日期:2005年11月10日/收稿日期:2006年2月14日/在线出版日期:2007年4月7日©施普林格Science+Business Media B.V. 2007
多年来,病毒已被证明是多种疾病的致死因子浮游植物物种,包括棕囊藻属的种类(Prymnesiophyceae).由于其多态的生命周期,其全球分布,以及几个Phaeocystis物种形成密集开花的能力,该属是我们理解元素的生物地球化学循环的关键角色。本文概述了迄今为止病毒在调节棕囊藻种群动态中的生态作用。它探讨了影响藻类宿主-病毒相互作用的变量,并检查了病毒诱导的phao -cystis细胞裂解对功能和结构的影响远洋食物网以及有机碳和营养物质的流动。
关键词特征•死亡率•Phaeocystis•Phycodnaviridae•PgV•病毒
C. P. D. Brussaard(&)•a.c。Baudoux•P. Ruardij生物海洋学系,荷兰皇家海洋研究所,邮政信箱59号,登堡1790AB,荷兰,e-mail:(电子邮件保护)
g . Bratbak
卑尔根大学生物系,Jahnebakken 5,5020卑尔根,挪威
缩写
震动棕囊藻属globosa但是此属病毒
PpV袋状Phaeocysis pouchetii病毒
TEP透明外聚物颗粒
MPN最可能数
透射电镜DsDNA双链DNA
有害藻华物种
脉冲场凝胶电泳
二甲基硫化物
DMSP Dimethylsulfoniopropionate
溶解有机碳
溶解有机质
简介
多年来,人们已经认识到海洋环境中存在病毒,现在已经确定,病毒是微生物食物网的动态和重要成员(Bergh etal。1989;Proctor和Fuhrman 1990;Gobler等人,1997;Fuhrman 1999;Wommack和Colwell 2000;Weinbauer 2004)。病毒不仅感染数量占优势的细菌,而且也感染原核和真核的初级生产者。单细胞光合生物是自然水生群落中的主要生物群,病毒已被认为是浮游植物的死亡因子(Van Etten et al. 1991;里斯1993; Brussaard 2004). Viruses or virus-like particles have been reported in many different taxa of真核藻类,包括有害藻华(HAB)物种(见Brussaard 2004年的综述;Nagasaki等,2004;Tomaru等,2004;Baudoux和Brussaard 2005)。
浮游植物生物量的命运,无论是通过下沉、放牧还是细胞裂解,都对海洋生态系统中的碳和能量循环具有重大影响。裂解介导的细胞内容物释放可以极大地增强细菌活性,随后迫使食物网朝着更再生的系统发展。细胞裂解和排泄所释放的能量和营养物质通过微生物循环被转移到更高的营养水平(Azam et al. 1983)。浮游植物的裂解病毒感染导致细胞快速裂解,不仅影响能量和养分的流动,而且影响浮游植物群落的组成和演替。认识到浮游植物的病毒裂解是一个主要过程,强调了微生物回路的重要性,包括病毒分流。
理论模型表明,由病毒感染引起的浮游植物2-10%的损失会使有机碳流量、细菌产量和呼吸增加25%以上(Fuhrman 1999;Wilhelm and Suttle 1999)。特别是在藻华期间,当藻类细胞丰度高时,病毒-宿主相遇率提高,病毒介导的裂解可以对种群动态、群落多样性和细菌繁殖产生深远影响能量转移以及远洋食物网中的物质。
Phaeocystis属,具有世界性的分布,包括几个高生物量形成的物种(Cadée和Hegeman 2002;Verity and Medlin 2003;Schoemann et al. 2005)。棕囊藻的生命周期主要由单细胞(有或没有鞭毛)和嵌套的无鞭毛细胞组成。几种Phaeocystis,如P. pouchetii和P. globosa,经常在浮游植物群落中占主导地位,并以菌落形式隔离大量的营养资源。这些水华主要发生在较冷和温带水域,如北大西洋和北海的沿海地区。因为这些花的重要性深海生态系统以及这些赤潮物种的社会经济利益,对控制这些藻华盛衰的因素进行了大量研究。光和营养是引发棕囊藻开花的重要因素,掠食和病毒被认为是相关的损失因素。实地研究表明,这些病毒是一个动态的组成部分,特别是与开花的减少有关。实验室和实验室研究深入了解了宿主-病毒的相互作用,并揭示了环境因素如何影响病毒感染。本论文的范围是对与Phaeocystis及其感染病毒相关的现有信息和一些未发表的数据进行总结和综合。
感染棕囊藻病毒的分离与鉴定
感染棕囊藻的病毒在自然开花期间和自然开花后直接被分离出来(Jacobsen等,1996年;Brussaard等,2004;Baudoux和Brussaard 2005)。棕囊藻属pouchetii但是此属通过持续离心和暴露于紫外线(UV) 15和30 s,在浓度为100倍后成功分离出病毒(PpV) (Jacobsen et al. 1996)。暴露在紫外线下旨在诱导含有溶原性病毒的藻类细胞产生病毒,但由于分离出的病毒是溶出的,这种处理很可能是不必要的。到目前为止,所有感染真核微藻的病毒都是溶性的,没有报道与宿主发生溶原关系。从过滤过(GF/F Whatman玻璃纤维过滤器)的天然水中分离出球状Phaeocystis globosa病毒(PgV),并将其添加到指数增长的球形Phaeocystis globosa宿主培养物中(Baudoux和Brussaard, 2005年)。在原处温度和辐照度(不含紫外线)下,将添加营养物质的天然海水孵育一周,然后再向球形P. globosa培养物中添加子样本,偶尔能成功分离PgV。在繁殖期的衰退期,也就是大多数游离病毒可能出现的时候,营养物质通常会消耗殆尽。添加营养物质可增加藻类生物量,提高藻类宿主与病毒的相遇率。
到目前为止分离出的棕囊藻病毒是种特异性的,即它们只感染其中一种棕囊藻(Jacobsen et al. 1996;Bau -
doux and Brussaard 2005)。并不是所有的球形假单胞菌或袋状假单胞菌宿主菌株都被相同的病毒分离物感染,也不是所有分离的病毒都感染相同的藻类宿主菌株。这些藻类病毒可能具有高度的特异性。
迄今为止在显微镜下观察到的所有细胞内Phaeocystis病毒颗粒都位于藻类宿主细胞的细胞质中,其轮廓呈六角形,无包膜,并且没有尾巴。基于透射电子显微镜(TEM)薄片显微图,颗粒的直径在100到160 nm之间(在薄片制备过程中,当受到固定和脱水时,颗粒趋于收缩)。病毒的六边形轮廓表明病毒粒子可能包含一个二十面体衣壳(图1)。最近在3nm分辨率下使用电子冷冻显微镜和三维图像重建方法对PpV的原始形态进行了研究,发现衣壳在相对顶点之间的最大直径为220 nm,由2192个capsomers组成,这些capsomers以大型三角形和五边形聚集体组织(Yan et al. 2005)。
利用DNA聚合酶基因片段的氨基酸序列进行的系统发育分析也表明,球形假单胞病毒和感染另一种芽孢植物(短丝菊)的病毒具有共同的祖先(Brussaard等人,2004年)。本研究还表明,7个PgV分离株与其他真核藻类病毒形成了一个独特的单系群,尽管在功能上存在差异
图1袋状褐囊藻感染细胞薄片的透射电子显微图。(a)在细胞质中发现病毒样颗粒(箭头所示)。(b)显示病毒六角形轮廓、基因组大小和其他表型特征的病毒样颗粒细节。Wilson等人(2006)最近从英国英吉利海峡的地表水中分离出一种感染球形假单胞菌的病毒,该病毒不与其他pgv聚类。相反,它与C. brevifilum更接近。
DNA聚合酶基因可以使用藻类病毒特异性引物AVS1和AVS2进行扩增(Chen和Suttle 1996年),这一事实允许将这些病毒分配到物理病毒科(Van Etten 1995年)。许多具有特征的浮游植物病毒确实属于感染真核藻类的大型双链DNA病毒家族。使用高度保守的DNA聚合酶基因被证明是一个很好的遗传标记分类的dsDNA藻病毒。phao -cystis病毒确实具有较大的dsDNA基因组,PpV的dsDNA基因组大小约为485 kb (Castberg et al. 2002), PgV的dsDNA基因组大小为177或466 kb(图2;Baudoux和Brussaard 2005)。在用敏感的核酸特异性染料(如SYBR Green I)染色后,这些大基因组大小的Phaeo-cystis病毒可以很容易地用外荧光显微镜或流式细胞仪检测到(Marie et al. 1999)。此外,流式细胞试验的使用允许将这些病毒与其他病毒区分开来,如许多其他藻类病毒(Brussaard等,2000年)或天然样品中的噬菌体(Larsen等,2000年)。2001;Baudoux和Brussaard 2005)。快速和客观地检测、鉴别和列举含有Phaeocystis病毒的样本的能力促进了病毒-宿主相互作用的实验室研究以及该领域的生态学研究。
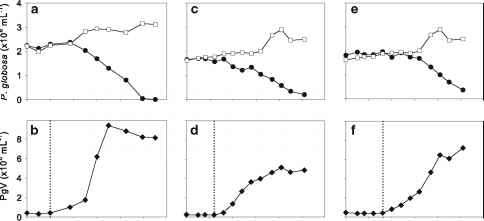
详细的实验室研究表明,Phae-ocystis病毒感染指数增长的宿主细胞的溶解生长周期的总长度在25至50小时之间(Jacobsen等,1996;Baudoux和Brussaard 2005)。对于PpV,从感染到细胞外游离病毒丰度首次增加的潜伏期约为12-18小时(Jacobsen等,1996年)。Baudoux和Brussaard(2005)的研究显示,培养的各种PgV分离物有3个不同的潜伏期,即10、12和16小时(图3)。这些时间段与迄今为止所有特征的浮游植物病毒的潜伏期范围相吻合,并且在一定程度上
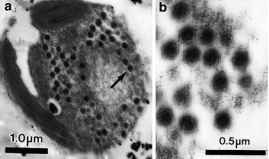
图1袋状褐囊藻感染细胞薄片的透射电子显微图。(a)在细胞质中发现病毒样颗粒(箭头所示)。(b)显示病毒六角形轮廓的病毒样颗粒的细节
图2脉冲场凝胶电泳(PFGE)测定不同球形Phaeocystis globosa病毒分离株(PgV)的病毒基因组大小。Lane M: Lambda concatamers ladder, Lane 1:未感染的P. globosa培养物,Lane 2: PgV-04(基因组大小为175 kb), Lane 3: PgV-12 T(基因组大小为465 kb)。在第1-3行所见的小条带(约45 kb)对应于噬菌体,因为藻类培养物不是无菌的
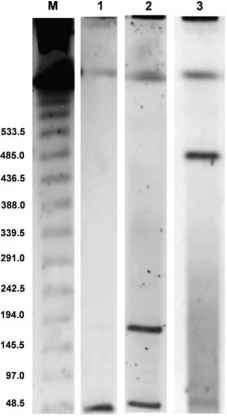
图2脉冲场凝胶电泳(PFGE)测定不同球形Phaeocystis globosa病毒分离株(PgV)的病毒基因组大小。Lane M: Lambda concatamers ladder, Lane 1:未感染的P. globosa培养物,Lane 2: PgV-04(基因组大小为175 kb), Lane 3: PgV-12 T(基因组大小为465 kb)。在1-3条带中看到的小尺寸条带(约45 kb)对应于噬菌体,因为藻类培养物不是无生的更短,也不能与其宿主的最大生长速率相比较(Schoemann et al. 2005;Vel-dhuis et al. 2005)。根据藻类宿主种群的减少和细胞外病毒颗粒的增加,可以估计出爆发大小(每个宿主细胞进行裂解释放的病毒数量)的保守估计。对于这两种Phaeocystis物种,爆发大小平均在250到500之间,P. pouchetii的爆发大小更高。不同PgV分离株之间的爆发大小差异很大,尽管藻类宿主细胞呈指数级增长,但爆发大小可降至100左右(baudoux和Brussaard 2005)。虽然爆发大小强烈影响宿主群体中剩余细胞的感染机会,但并非所有病毒都具有传染性。在指数增长的培养中,由最可能数(MPN)法确定的感染棕囊藻病毒产生的百分比通常相对较高,从60%到100%左右(Bratbak等人,1998年;Brussaard unpubl。 data).
感染期间宿主种群的形态、生理和活力状态很好地说明了溶病毒感染对Phaeocystis细胞的毁灭性影响(Jacobsen等人,1996年;Bratbak et al. 1998, Brussaard et al. 1999,2001)。尽管受感染藻类细胞的光合装置在感染后的Wrst小时内似乎是活跃的,但在潜伏期结束时观察到细胞的光合效率突然急剧下降(图4)。与上述反应整个种群状态的测定相反,流式细胞术的使用允许对单个细胞进行分析。病毒感染细胞的细胞特性变化在时间上是动态的,在感染后的Wrst小时内,细胞DNA增加的细胞比例增加,随后病毒粒子形成时,细胞散射信号下降。在细胞裂解之前,红色自发荧光随细胞器的破坏而下降(通过透射电镜观察到)。当Wrst病毒从宿主细胞中释放时,死亡细胞的比例增加(Brussaard et al. 2001)。最后,在细胞裂解期间,显示细胞DNA浓度降低的细胞亚群发展并随时间增加。
Phaeocystis virus的发生与动态
虽然对含有病毒样颗粒的棕囊藻细胞的观察和感染棕囊藻物种的病毒的分离表明病毒可能是潜在的重要因素,但在半自然条件下,棕囊藻藻细胞和游离病毒的继承暗示了直接的因果关系和生态学意义。目前,已经进行了两项介体研究和两项Weld研究,均显示出高度动态的Phaeocystis病毒丰度随时间的变化
-
- 0 10 20 30 40 50时间(h)
图3根据Baudoux和Brussaard(2005),球形Phaeocystis globosa (a, c, e)和PgV (b, d, f)的丰度。开放的方形符号表示未感染的培养物,而填充的圆圈表示病毒感染的球形假单胞菌。(a) PgV-07T感染的球形假单胞菌,(c) PgV-05T感染的球形假单胞菌,(e)
PgV-04T。填充菱形符号表示(b) PgV-07T, (d), PgV-05T, (f)和PgV-04T的病毒生长周期。潜伏期(虚线所示)PgV-07T为10小时,PgV-05T为12小时,PgV-04T为16小时
图3根据Baudoux和Brussaard(2005),球形Phaeocystis globosa (a, c, e)和PgV (b, d, f)的丰度。开放的方形符号表示未感染的培养物,而填充的圆圈表示病毒感染的球形假单胞菌。(a) PgV-07T感染的球形假单胞菌,(c) PgV-05T感染的球形假单胞菌,(e)
并与宿主的丰富程度密切相关(Larsen et al. 2001;Brussaard等,2004;Brussaard等,2005a;Baudoux et al. 2006)。在所有这些研究中,棕囊藻病毒在盛期的丰度比其宿主的丰度高30- 100倍,这表明病毒确实应该被视为球形P.和P. pouchetii的重要死亡因子。在研究期间,Phaeocystis病毒通常占病毒总数的0 - 5%,这与Phaeocystis是否主导浮游植物群落无关。由于细菌在数量上是最丰富的,Phaeocystis病毒的低份额是可以预料的。然而,与集落形态相比,在有利于单细胞形态的特定条件下,PgV的比例增加到病毒总丰度的30% (Brussaard等人,2005a)。在这种条件下,病毒实际上能够阻止球形P. globosa的蓄积(即开花)。
这里需要注意的是,Phaeocystis的成功感染并不取决于Phaeocystis病毒的总丰度,而是取决于传染性病毒的数量。最近发表的一个生态系统模型,用来自球形P. globosa介观实验的大数据集校准(Ruardij et al. 2005)表明
PgV-04T。填充菱形符号表示(b) PgV-07T, (d), PgV-05T, (f)和PgV-04T的病毒生长周期。潜伏期(虚线所示)PgV-07T为10小时,PgV-05T为12小时,PgV-04T为16小时
成功感染P. globosa细胞的感染性PgV在开花过程中急剧增加,最高达到0.035(图5)。当单细胞占主导地位时,成功感染P. globosa的感染性PgV比例最高。在菌落解体后形成的透明外聚颗粒(TEP)对PgV的吸收减少了可用的感染性PgV,并随后减少了成功感染球形P. globosa的PgV的比例(图5)。开花形成前的非常低的值(0.0005%)代表了生长季节开始时的情况,当时PgV蓄积在很长一段时间内(秋季至春季)失去了传染性,实际病毒颗粒下降。与此同时,当寄主细胞数量非常低且几乎不生长时(由于冬季光照和温度的限制),球状P. globosa的新病毒产量并不显著。在北海南部浑浊的沿海水域进行的Weld研究表明,传染性PgV的分数约为0.04 (baudoux etal.)。, 2006),与模型情况吻合得很好。值得注意的是,囊袋假单胞菌也需要较低的宿主-病毒吸附效率,才能在模拟和实验观察之间产生合理的良好Wt (Bratbak et al. 1998)。
继续阅读:信息原则
这篇文章有用吗?
