导致一氧化二氮形成的大气过程
云层和雾中的水滴、硫酸和微粒等非均匀过程对大气微量气体的化学转化和去除对大气化学非常重要,因为众所周知,这些过程可以导致气相光化学的重大变化。为了去除大气中的氮化合物,导致最终最终产物硝酸(HNO3)的异相反应是特别感兴趣的。然而,这些反应也可能导致,至少部分,形成其他氮物种,如亚硝酸(HONO)和氧化亚氮。
在20世纪90年代中期的一项研究中,Wiesen等人(1995)在模拟大气条件下的11升耐热玻璃反应器(表面与体积(s:v)比~22m~1)和64升石英玻璃反应器(s:v比-21m-1)中研究了NO2在不同表面上的非均质转化。石英玻璃反应器配有白镜系统(底座长度为2.0m),并在减压条件下运行,从而可以通过长路径可调谐二极管激光吸收光谱(TD-LAS)对不同种类的浓度进行原位测量。
在第一组实验中,作者研究了NO2在石英玻璃反应器(白细胞)中在黑暗中的异质转化。在干燥的合成空气中,初始NO2浓度从1.5 ppm到26ppm不等,测定了NO2、HONO和N2O的浓度-时间分布。图9.5显示了NO2、HONO和N2O的典型浓度-时间分布。
-
![Figure 9.5 NO2, N2O and HONO concentration-time profiles in the quartz glass reactor (White cell) in the dark; [NO2]0 = 21.2ppm, ptot = 6.5torr (c. 870Pa) synthetic air Source: Wiesen et al (1995) No2排放主要源](//www.zandimusic.com/oxide-emissions/images/3400_104_45-no2-emmision-major-sourse.jpg)
- 图9.5黑暗条件下石英玻璃反应器(白色电池)中NO2、N2O和HONO浓度-时间分布图;[NO2]0 = 21.2ppm, ptt = 6.5torr (c. 870Pa)合成空气来源:Wiesen et al (1995)
由于很难控制不同反应器的表面活性,因此对实验装置进行了修改。用长径吸收赫里奥特细胞代替白细胞监测不同的物种。此外,11升耐热玻璃反应器中的混合气体被连续泵入含有不同溶液的起泡器,使用明确的参数,如浓度、温度、体积、流速和气泡直径。观察到,N2O在H2SO4、HCl、HClO4和H3PO4等酸性溶液中形成,而在水或不同的盐溶液中没有观察到N2O的形成(图9.6)。
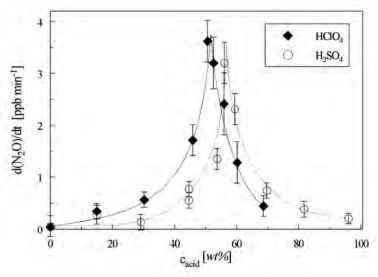
图9.6在改进的实验装置(耐热玻璃反应器、起泡器、
赫瑞特细胞);[NO2]o = 25ppm, ptt = 740torr (c. 99kPa), Vh2so4 = 200mL来源:Kleffmann et al (1998b)
图9.6在改进的实验装置(耐热玻璃反应器、起泡器、
赫瑞特细胞);[NO2]o = 25ppm, ptt = 740torr (c. 99kPa), Vh2so4 = 200mL来源:Kleffmann et al (1998b)
根据实验观察,作者提出了以硫酸为反应物的反应机理:
8no2 + 4h2o 2hono + 2h2so4
(表面)
2no + hso4 - + 2hono + 2h2o ^ (hon)2 ^
(hon)2 + 2hno3 + 2h2so4 (9.7) n2o + h2o (9.8)
N2O + 6HNO3(净反应,9.9)
在第一步,9.5反应中,NO2在表面转化为HONO和HNO3。在反应体系中,NO2衰变常数与NO2浓度和硫酸溶液的体积无关,但与表面积成正比。因此,观察到的NO2衰变应该主要是由硫酸溶液中NO2的摄取引起的。
第二步,反应9.6,溶解的HONO与硫酸反应生成NO+HSO4~。本文提出亚硝基阳离子(NO+)作为强氧化剂氧化HONO生成HNO3,反应9.7。通过这个反应NO+被还原为(HON)2,很容易分解成N2O和水,反应9.8 (Greenwood和Earnshaw, 1984)。
对于H2SO4浓度>55 wt % HONO几乎完全转化为NO+HSO4-。因此,在气相中观察不到HONO,反应9.7变慢,因为没有HONO。因此,可以形成更少的(HON)2,从而减少N2O的形成。当H2SO4浓度较低时,N2O产率也较小。这可能是由于NO+HSO4-的生成产率低,反应9.6,因为已知NO+HSO4-在过量的水中是不稳定的(Coleman et al, 1939)。根据提出的机制,观察到的N2O形成速率最大值必须出现在NO+和HONO浓度相等的H2SO4和HClO4浓度下。在先前的研究中,NO+和HONO之间的平衡作为酸浓度的函数进行了研究,报告了56% wt的H2SO4中NO+和HONO的数量相等(Seel和Winkler, 1960;贝利斯等人,1963年;Becker等人,1996年)和52 wt % HClO4 (Singer和Vamplew, 1956年;特尼和赖特,1958年; Bayliss et al, 1963), which is in excellent agreement with the result from the present study.
需要指出的是,所提出的反应机理也可以解释实验观察到的在其他酸溶液(如HCl和H3PO4)存在下N2O的形成。
为了估计所研究的转换过程对全球N2O预算的可能影响,对大气气溶胶的s:v进行了简单的估计,该气溶胶为3 × 10-4 cm2 cm-3,通常在严重污染的气团中观测到。此外,假设5%的气溶胶由56 wt %的H2SO4组成,吸收系数为3 X 10-7 (Kleffmann等人,1998a)。NOx的全球源强度为160Mt yr-1(作为NO2) (Lammel和GraEl, 1995年),大气NO2转化率为10%小时-1 (Finlayson-Pitts和Pitts, 1986年)。基于这些假设,计算出由NO2转换产生的全球N2O源强度为100kt N2O/年。
如果考虑到N2O的形成也发生在含cH2SO4 >56 wt %的气溶胶上,以及其他来源,例如土壤上的NO2转换过程,有助于大气HONO的形成,则可以大致估计出由NO2转换产生的全球N2O源强度的上限为0.3Mt N2O年-1。这一结果可以与全球N2O预算中约3Mt N2O/年的赤字进行比较。因此,只有10%的亏损可以解释为异质NO2在酸表面的转化。
Behnke等人(1997)提出的大气中N2O形成的另一个可能来源是N2O5与氨在湿气溶胶上的非均相反应。Zellner等人(1992)、Maric等人(1992)以及Kummer和Zellner(1997)提出了另一种可能的来源:通过电子激发NO2和NO3自由基与分子氮发生反应性碰撞猝灭的气相反应,在大气中光化学生成N2O。Adema等人(1990)提出在含有NO2、O3和氨的空气中形成N2O的不均匀性。作者提出了一个相当复杂的反应机制;然而,他们并没有提供根据所建议的机制在大气中可能形成多少N2O的估计。
继续阅读:一氧化二氮生产硝酸
这篇文章有用吗?
![Figure 9.5 NO2, N2O and HONO concentration-time profiles in the quartz glass reactor (White cell) in the dark; [NO2]0 = 21.2ppm, ptot = 6.5torr (c. 870Pa) synthetic air Source: Wiesen et al (1995) No2排放主要源](http://www.zandimusic.com/oxide-emissions/images/3400_104_45-no2-emmision-major-sourse.jpg)