环境中的厌氧氨氧化
自然系统中厌氧氨氧化活性与固定无机氮的去除之间的联系首次在黑海亚缺氧水柱中得到证实(Kuypers et al. 2003)。从那时起,厌氧氨氧化已被证明是多种环境中氮损失的重要因素,在缺氧的沿海海湾中,厌氧氨氧化造成了19-35%的氮损失(Dalsgaard等人,2003年),在世界海洋最多产的地区之一——南海,厌氧氨氧化造成了大部分的氮去除本格拉上升流氧气最小区(Kuypers et al. 2005)。这些地点表现出最低氧区特征,被认为是全球氮去除的30-50%的原因(Brandes和Devol 2002)。沉积物或土壤中厌氧氨氧化反应的证据通常首先由孔隙水N剖面确定。缺氧区其中亚硝酸盐/硝酸盐和铵的同时减少代表厌氧氨氧化活性所需的初始条件(图10.3)。据报道,厌氧氨氧化的最大贡献为67-79%,出现在700米深度的沉积物中(Engstrom等人,2005年),这导致了一个假设,即厌氧氨氧化的相对贡献随着深度的增加而增加。然而,目前的证据表明,在深海沉积物(约3000米)中,厌氧氨氧化占总N2产量的13%至51%。
铵在缺氧系统中通常是丰富的,由有机物氧化提供。硝酸盐还原菌或好氧氨氧化菌为厌氧氨氧化反应提供必要的亚硝酸盐。因此,有机物的可用性是
-
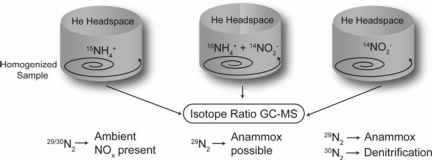
- 图10.3估算厌氧氨氧化和反硝化活性的同位素配对技术的实验布局
被认为是影响厌氧氨氧化对总N2产量相对重要性的主要因素。有机物利用率越高,反硝化菌对NO2-和NO3-的需求就越高,而厌氧氨氧化释放的NO2-就越少。因此,在亚热带红树林沉积物中,厌氧氨氧化贡献了0-9%的总N2产量(Meyer et al. 2005)河口沉积物(Trimmer et al. 2003),在富营养的浅海岸湾沉积物(Thamdrup和Dalsgaard 2002)。尽管沉积物反应性与厌氧氨氧化对总N2产量的贡献呈负相关(Trimmer et al. 2003),但厌氧氨氧化绝对速率似乎在反应性中等的地点达到峰值(Engstrom et al. 2005)。因此,厌氧氨氧化活性与有机质有效性之间的严格关系尚未牢固确立。此外,由于厌氧mox生长缓慢,且受低浓度O2的抑制(如果“海洋”厌氧mox的反应与“淡水”物种相同),环境稳定性可能是厌氧mox活性的重要控制因素。
与海洋厌氧氨氧化相同或密切相关的16S rRNA序列广泛分布于海洋系统、淡水湖和亚热带湿地(Penton and Tiedje 2006)。然而,研究厌氧氨氧化活性的研究相对较少淡水系统,尽管“淡水”厌氧氨氧化细菌因其在废水处理生物反应器中的应用而得到了最密集的研究。舒伯特等人(2006)报道,在美国最大的淡水缺氧湖泊中,厌氧氨氧化贡献为13%世界,湖坦噶尼喀。在缺氧水柱中鉴定出与Scalindua brodae Anammox 16S rRNA基因序列,序列一致性为> 96%,并用FISH法对Anammox细胞进行计数。采用分子分析方法对信宜地区厌氧氨氧化菌种群多样性进行了评价河(中国(Zhang et al. 2007)。包括坦噶尼喀湖研究获得的序列在内,通过靶向PCR获得的序列与Brocadia anammoxidans和Candidatus Scalindua物种的16S核苷酸同源性分别为95%和95%。这些发现表明,淡水栖息地中可能存在更多样化的厌氧氨氧化菌群落,而大量的海洋研究表明,厌氧氨氧化菌的生态类型是单一的、占主导地位的。
继续阅读:结论氯氟化碳
这篇文章有用吗?
