冻土微生物活性评价技术921多年冻土取样和样品处理
通常的做法是确保永久冻土岩心不受化学物质或外来微生物的污染(Shi et al. 1997;Rivkina et al. 2004)。为了达到这一目标,切割设备(螺旋钻、凿子、圆盘锯)的所有机械部件在收集下一次样品之前都要清洗(例如,用乙醇或其他防腐剂)。当我们分析时,这个条件是松弛的表面冻结通常受到异源性生物密集殖民化的土壤(大气沉积,径流,借用动物,添加粪便等)提取的芯立即密封在塑料袋中,并在运输和储存过程中保持冷冻;在每一步,温度都由微记录仪监测,以排除样品的意外变暖。微生物分析,如电镀或DNA提取之前,用无菌手术刀剃芯表面。
当任务是测量零度以下的微生物活动时,出现了几个额外的要求:
(a)如何将冻结的岩心分割成小尺寸的团聚体,以便填充到试管中进行后续活性检测
(b)如何在对冻土及其群落扰动最小的情况下,添加可溶性基质(葡萄糖、琥珀酸盐等)或不可溶性基质(淀粉、纤维素)
(c)如何避免对严格厌氧菌造成氧气压力
(d)如何防止样品在长期孵育过程中干燥等。
所开发的程序(图9.2)满足大多数所需条件。在持续冷却和N2流动下,将原30-50厘米的核心破碎成2-3厘米的部分,然后在聚丙烯套筒内破碎成3-8毫米的团聚体,从而实现均质化。修改底物最简单的方法是使用气体和挥发性化合物(CO2、乙醇、甲烷和其他碳氢化合物、挥发性脂肪酸等),并将它们添加到碾碎的土壤上方。可溶性底物需要初步的短期冻土融化。我们尝试添加可溶性和不溶性底物(纤维素)作为冷冻粉末,但从未检测到它们在-10°C以下的转变。卧式冷柜比立式冷柜更有优势,带有适当浴液(乙醇,聚二甲基硅氧烷)的循环恒温器显然优于干式冷柜,因为即使在经常访问的情况下,温度稳定性更高(±0.1°C)。酒精浴(恒温)和铝块(温度梯度)为顶空气体采样提供了独特的机会:保存有冻土层的小瓶保持在给定位置
-
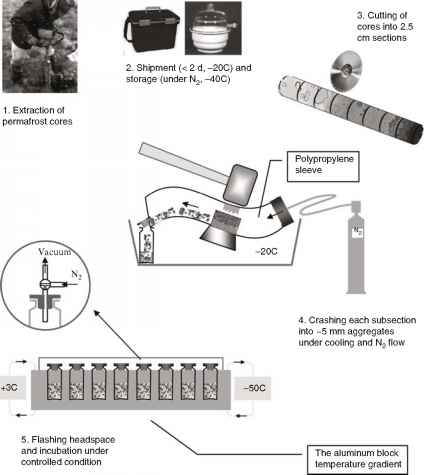
- 图9.2为测量包括严格厌氧菌在内的原生多年冻土微生物代谢活性而对多年冻土样品进行采样和处理
在零度以下的温度下,橡胶隔垫保持在冷却范围之外,保持柔软和弹性,以抵御多次针穿,并易于分析。
继续阅读:各种微生物活性检测方法的优缺点
这篇文章有用吗?
