动力学
最初的光催化反应速率遵循Langmuir-Hinshelwood类型的关系对初始有机物浓度(31日9日26日至29日,33岁,39岁,42岁,48岁,49岁,59岁,60岁,63 - 65年):
CQ就是目标的初始浓度有机化合物。常数k和k代表集合的氧化,重组,可能吸附条件。这个表达式描述了一个一阶反应在低基质浓度,过渡到一个独立的有机浓度高衬底载荷(图2)。速率表达式可以由往复式线性化,导致
1 _ JL /伊犁rQ ~ kK法院+ k(自由)
从而为l / rQ描述线性情节和1 / C„(图2中,曲线B)。二次有机物质,通过氧化形成的过程中,完成与原基质的氧化剂(1羟基自由基),所以后来反应率可能比初始速率慢。
一些操作和解决方案的影响参数对PCO反应速率一直在评估。在许多情况下,这些参数的影响相比使用速率常数(水)源自一阶线性短范围的情节。别人取得了比较不同反应条件使用初始利率(rj,线性降低浓度测量在一个短暂的时期。
Langmuir-Hinshelwood氧浓度的依赖已经决定[63]:
率= 1 + r (o2) (12)
氧气是必要的完整的氧化反应,反应photoproduced电子(地表Ti (III))通过反应(6)保持电中性。
的入射光强度控制电子/孔生产,因此氢氧自由基的形成率。例如,直接光强度之间的线性关系和PCO率已经发现了间甲酚[43]。然而,从一阶过渡到1/2阶发现在高光照强度(63、66)。这显然是由于氢氧自由基增加重组,
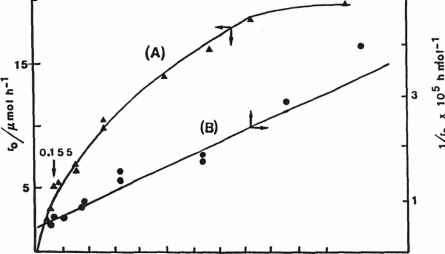
图2 (A)初始3-chlorophenol浓度与初始PCO率。(B) 1 / CQ与l / rD。(允许转载来自D 'Oliveira et al。[39]。版权1990年美国化学学会)。
图2 (A)初始3-chlorophenol浓度与初始PCO率。(B) 1 / CQ与l / rD。(允许转载来自D 'Oliveira et al。[39]。版权1990年美国化学学会)。
产生复合率成正比哦——”2。这因此产生整体有机氧化速率与光强度的平方根成正比[67]。
量子产率是一个衡量光的利用率和效率被定义为光子进入的数量的比率光化学反应光子的数量。前的转换参数评估通常是通过底物,后者通过测量入射光特征。
3的退化,4-dichlorobiphenyl照亮了TiOz Tunesi和安德森[47],两个光强度进行评估;光强度的增加导致更快的去除率,但一个较小的量子产率,由于低效的光利用率和增加激进的重组,正如上面所讨论的。中间产品隔离包括线性和支链的碳氢化合物和酚类化合物。量子收益率介于7.4 4 X打败1.6 X 1 (T3。PCO的量子产量0.06醋酸[51]0.022,水杨酸[48]也被报道。
因为关键步骤Ti02 Ti02表面(即光催化氧化发生。反应(2)和(6),反应速率会增加可用线性与催化剂。在稀释TiOz浓度,观察到这样一个关系。然而,超过一定浓度,氧化的速度不会增加(34岁,36岁,63年),如图3所示,可以减少Ti02浓度进一步增加。例如,马修斯[20]发现水杨酸的生成速率与苯甲酸钠的氧化二氧化钛的数量多达2 g / L,但在较高的加载略有下降。Augugliaro等。[33]观察到相同的现象,最大酚1 g / L TiOz PCO速度。马修斯
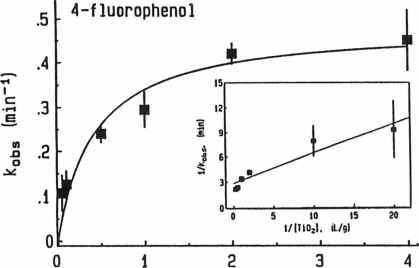
图3依赖水的光催化剂浓度4-fluorophenol的光催化氧化。插图显示的线性往复Langmuir-Hinshelwood表达式。(允许转载Minero et al . [36]。版权1991年美国化学学会)。
图3依赖水的光催化剂浓度4-fluorophenol的光催化氧化。插图显示的线性往复Langmuir-Hinshelwood表达式。(允许转载Minero et al . [36]。版权1991年美国化学学会)。
[61],分析4-chlorophenol降解利用方程(11),发现k下降而k增加Ti02加载不同的从0.2到2 g / L。
这些结果解释某些Ti02浓度以上,有一个化学计量Ti02加载足以使用所有可用的光子在给定的强度。增加Ti02浓度超过这个水平变得无关紧要,因为所有可用的光被利用。除此之外,其他因素导致的独立Ti02浓度包括反应堆配置,反射,不透明度和解决方案,这可能会禁止的一些光激活可用的光催化剂。
pH值对PCO反应动力学的影响很大程度上仍未解决。某种类型的pH值的依赖,尽管它通常是轻微的,指出了几乎所有的有机基质。然而,它不可能得出任何一般的结论对pH值关于光催化氧化动力学。在某些情况下,有差异的pH值的最大速率相同的有机化合物。例如,苯酚PCO的最大速率一直在报道pH值3×Augugliaro et al .[33],在pH值4 - 5 Okamoto et al。[24],以及pH值5 - 9曾和黄[34]。
PCO的一些非离子化合物,如溶剂、影响解决方案博士马修斯[65]发现,利率的二氧化碳生产苯、硝基苯、氯仿(量化的产品kK使用方程(11)]在pH值4.5比pH值3.0更快。然而,二恶英PCO被发现在基本条件下更快[10]。
pH值的影响的PCO游离有机酸是由这些化合物的形态变化复杂。在大多数情况下,阴离子有机物比pro-tonated分子活性物种,这是常见的亲电氧化。氧化pen-tachlorophenolate离子的高酸度分子五氯苯酚的收益高于3 [35]。发现了类似的结果间甲酚[43]和4-chlorophenol [37]。Palm-isano等。[68]研究了pH值对的初始反应速率的影响苯酚和2 -,和
3 -,4-nitrophenols。最高的光敏碱性地区被发现。pH-dependent 3-Nitrophenol光催化氧化是小于2 -和4-isomers。草酸的PCO率最大值pH值2.3和更高的pH值下降,显然是由于物种形成的变化从HC204 ~ C2042 - [9];然而,醋酸光催化氧化是最大的pH值3 [51]。三个商业偶氮染料的光催化氧化和模型化合物,4-hydroxyazobenzene,被Hustert检查,泽普[53],橙色G被氧化更快酸碱12比7,显然是因为这个弱有机酸的去质子化染料。
除了衬底物种形成机制可能负责pH值依赖关系包括表面水解Ti02(双电层的后续更改),pH值依赖的任何产品或反应物的吸附(02,h2o,哦——或有机),以及pH值依赖特定有机底物的反应速率。例如,Kormann et al。[66]相关光催化氧化率随着pH值的函数计算表面物种形成三氯醋酸和chloroethylammonium离子吸附到Ti02。
二氧化钛有两个常见的晶体结构,锐钛矿和金红石。几项研究已经指出,金红石不是一个活跃的光催化剂(24、33),然而,两三个金红石催化剂检查Auguliaro et al。[33]有特定的表面区域明显低于锐钛矿的样本;因此直接比较可能不是完全有效的。然而,Sclafani et al。[69]指出的不活跃的金红石比表面积更大(20 m2 / g)比一个活跃的锐钛矿(14 m2 / g)。一个活跃的金红石光催化剂被戴维斯等人发现。[70],显然金红石Ti02的反应取决于Ti02合成[69]的方法,金红石的能带能量3.0 eV,相比3.2为锐钛矿。因此,氧化还原电位为金红石相略少,从热力学角度来看,一些反应可能不是与金红石青睐。Sclafani等。[71]认为PCO活动差异锐钛矿和金红石Ti02还原反应的热力学和动力学。尽管晶体结构Ti02的光催化反应中所起的作用,还有其他的控制参数时,必须考虑评估Ti02从不同的来源。
理论上,Ti02较高比表面积会增加其光催化活性由于增加了吸附面积HzO哦,和相应的后续代哦——自由基反应(2)。支持这个假设,马修斯[59]发现4-chlorophenol的降解率要低得多,同等浓度的La Porte TiOz(比表面积= 9 m2 / g)与德固赛TiOz (50 m2 / g),大概是因为它的表面积低很多。
另一方面,这个理论还没有被发现在其他研究中是一致的。调查Cuendet和Gratzel[72]在丙酮酸光催化反应发现相似率两个Ti02样本不同特定的表面区域(145 m2 / g和50 m2 / g)。田中等。[73]研究了退化三氯乙烯(TCE), 12日methylchloride酸,苯酚商用Ti02样本。降解率变化Ti02类型之一,但与比表面积没有相关性。利率是依赖于微晶锐钛矿的形式存在于Ti02样本的大小;微晶尺寸越大,反应速率越快。两个Ti02样品最快的锐钛矿(100%)利率观察特定的表面区域的17.3 m2 / g (Fujititan TP-2)和9.5 m2 / g(奥尔德里奇)。Sclafani等。[69]研究了几种商业和合成类型的Ti02拥有广泛的物理和化学性质,不同的晶体结构和比表面积等领域;相应地,广泛的PCO率被发现。没有光催化剂性质产生了相关性对反应速率。
颗粒大小可能影响PCO利率通过影响电子/空穴捕获的程度。随着粒径的增加,电子空穴对的距离必须通过固体扩散之前Ti02面上的反应增加。这同时增加了proba -
采样端口
C |
一个“ |
控制 反应堆 TiO、悬架 电磁搅拌器 温度 控制 反应堆 TiO、悬架 电磁搅拌器 长波紫外线灯 图4典型循环批反应堆中使用的光催化氧化动力学的研究。 性,重组将会发生。因此,任何降低利率的PCO大Ti02粒子可能是由于电子空穴复合程度就越大。戴维斯et al。[70]发现,取决于特定TiOz催化活性的催化剂合成TiOz(制造商),晶体结构,任何预处理的固体。之间不存在相关性的粒度Ti02和初始PCO甲苯。 几个调查人员已经报道了氯离子的不利影响PCO率[33 26日31日,38岁,66),氯的存在显著降低有机氧化率,可能通过清除一个活跃的激进的物种[74]: 抑制PCO的氯化过程中是一个严重的问题,因为氯形成矿化氯碳化合物的化合物,其中许多是发现在受污染的水域。阿卜杜拉et al。[74]曾和黄[38]检查了其他几个阴离子对PCO的有机基质。磷酸盐和硫酸盐反应速率下降,显然是被吸附到Ti02,导致一些活跃的站点的失活;N03 ~和C104 ~对PCO反应速率没有影响。 光催化氧化率减少碳酸氢根离子的存在。500 mg / L碳酸氢盐的存在降低了TCE速率常数实验台研究了2 - 5倍[75]。碳酸氢根离子是众所周知的激进的食腐动物通过调查工作臭氧化动力学。显然HC03 ~徒PCO期间以同样的方式,清除羟基自由基,从而防止与目标底物反应。 在许多情况下PCO动力学研究了使用再循环系统中混合反应堆提要一个孤立的活塞流photoreactor,类似于图4。通过这种方式,采样和悬挂化学监测和调整执行混合反应器,远离photoreactor。研究表明,PCO一级速率常数(水)流量的函数(FR)通过描述这些反应堆和方程[56] 在小流量,流量的增加导致更高的反应速率常数;成为独立的流率较高的流速。也发现类似的结果由Al-Ekabi和Serpone[21]在考试流过盘绕玻璃管内部Ti02涂料。 Minero等。[36]指出PCO的五个不同fluorophenols和difluorophe-nols非常相似。类似地,苯酚、氯酚同分异构体的三个,五个不同的二氯苯酚,2,4,6-trichlorophenol[38]都在30%左右。这两个调查说明PCO的nonselectivity系统。然而,相比之下,Terzian等。[43]发现,间甲酚的PCO速度慢约1/2倍比o -或p-cresol在相同的条件下。 有竞争力的相互作用在4-chlorophenol 2 4-dichlorophenol, 2, 4,考察了5-trichloro-phenol Al-Ekabi et al . [42]。所有三个化合物的PCO率放缓在三元混合物。然而,3个人率之和等于PCO的单一化合物,表明一个固定数量的氧化剂被照亮Ti02系统产生的。 绝对比较有机PCO率的各种调查人员是不可能由于底物的变化和催化剂加载,光强度,反应堆的配置。有些基础利率目标有机消失,而其他人则监控二氧化碳或CI -的生产。批处理和流反应堆使用暂停以及固定化光催化剂已被确认。讨论并给出了反应堆动力学对PCO利率的影响,戴维斯和郝[76]和Turchi Wolfrum [77], |
|
继续阅读:废物浸出TestsAn概述
这篇文章有用吗?