原则
在RED中,一个浓盐溶液和一个低浓盐溶液通过交替的一系列反应接触阴离子交换膜(AEM)和CEM(图8)。
浓缩盐溶液和稀释盐溶液由一系列交替的AEMs和CEMs分开。AEM包含固定的正电荷,只允许负离子选择性地向阳极移动,而CEM包含固定的负电荷,只允许阳离子选择性地向阴极移动。都是浓缩的
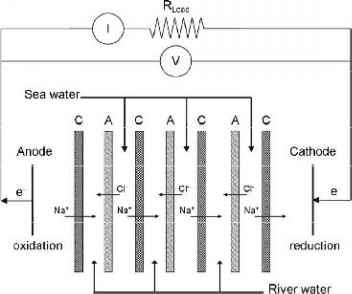
图8 RED原理A是阴离子交换膜,C A阳离子交换膜, V为外加外部负载的电位差(V), I为电流(A), RLoad为外部负载的电阻(O)。在电极上使用氧化还原偶以减轻电子从阳极到阴极[34]的转移。
图8 RED原理A是阴离子交换膜,C是阳离子交换膜,V是外加负载的电势差(V), I是电流(A), RLoad是外加负载的电阻(O)。在电极上使用氧化还原偶来减缓电子从阳极转移到阴极[34]。
稀释的进料舱包含一个间隔来控制流体动力学。在阳极释放的电子随后通过包含外部负载的外部电路传输到阴极。在堆叠的内部电路中,电荷由离子携带,而在外部电路中,电子携带电荷。离子电流通过发生在电池堆外侧电极上的氧化还原反应转化为电流。氧化还原偶被用来减轻电子的转移。目前常用的典型氧化还原偶联是K4Fe(CN)6和K3Fe(CN)6(铁(II)铁酸钾和铁(III)铁酸钾)在氯化钠散装溶液中的溶液。在阴极,铁(III)配合物被还原,铁(II)配合物在阳极被再氧化:
Fe(CN)6”+ e”2 Fe(CN)4”E0 = 0.36 V
溶液在两个电极室之间循环,以保持原来的铁(III)/铁(II)的比例。
不同浓度的两种盐溶液之间的化学电位差是这一过程的驱动力,并在每对膜上产生电压差。对于单价水电解质(如NaCl),膜上电位差的理论值可以用Nerst方程计算:
zF \adj,其中AVtheo为100%选择性膜的理论膜电位(V), R为通用气体常数[8.314J/(molK)], t为绝对温度(K), z为电化学价,F为法拉第常数(96,485 C/mol), ac为浓盐溶液的活性(mol/L), ad为稀盐溶液的活性(mol/L)。对于淡水(0.017 M NaCl, g 7 - 0.878)和海水(0.5 M NaCl, g + - 0.686),每膜理论电压差为80.3 mV。总的来说,系统的总电势是每对膜上的电位差之和(例如,100对膜提供100 x 80.3 - 8030 mV或8 V的电压差)。
从RED获得的功率密度(定义为每单位总膜面积产生的功率)等于外部负载上一半电流和电位差的乘积(类似于PRO,其中功率等于压力和通量的乘积):
1我
PrED = _Av = _(Af - AV)AV (21)
2 2r,其中pRED是RED获得的功率密度(W/m2), AV是外部负载上的电位差(V), r是面积电阻(O m2), Af是两种溶液之间的电化学电位差(V)。当式(21)相对于外部负载上的电位差求导时,可以计算出RED获得的最大功率密度。在最大功率输出时,dP/dAV为0,因此AV = Af/2时输出功率最大。在这种情况下,当将A V的这个值代入式(21)时,可获得的最大功率密度等于pRED = 1Af2 (22)
2 r 4
继续阅读:红色膜
这篇文章有用吗?
读者的问题
-
迈克尔3个月前
- 回复