信息Ixl
温度
图5.9温度T的相对位置,露点TD,湿球温度Tw的空气包裹。
5.9湿球温度,拼箱
一个空运的热力学状态是由温度决定的,压力和混合比。然而,在某些应用程序中是不方便使用混合比。例如,混合比是不易直接测量。还有另一个指标的大气水分称为湿球温度(Tw)可以测量更直接。之间的湿球温度谎言露点温度和空气温度(见图5.9)。
在引入湿球温度之前,让我们再次把露点温度也是一个测量空气中的水分。回想一下,这是必须冷却空气的温度恒定压力为了成为饱和对飞机表面的水。当我们执行冷却我们必须保持空气的混合比固定的。在这个温度的实际混合比就等于饱和混合比:
在温度高于露点的空气含有一些水分,但低于饱和值。当温度降低到露点发生凝结。因为露点的混合比等于饱和混合比,显然,露点温度总是低于或等于空气温度。如果两个很近,相对湿度是高。如果露点是远远低于空气温度,相对湿度低。人类的露点是一个很好的指标不适。当温度高与低TD更舒适而不是高露点温度,因为较高的相对湿度。当相对湿度高蒸发率从潮湿的表面低(实际上是成正比的相对湿度100 -百分比)。气象学家通常指温度和露点之间的区别,这叫做露点降低。
霜点定义类似于露点。霜点必须冷却空气的温度恒定压力为了成为饱和对飞机表面的冰。注意,在恒压冷却混合比是常数的一个包裹。
露点温度是很难直接测量。很容易测量湿球温度。这是湿表面的温度(名义上湿布裹着的灯泡温度计),沉浸在周围的空气中。湿表面水分蒸发到周围空气(通常小于饱和)这样湿表面的温度降低(与汗水为皮肤干燥的空气冷却)。潮湿的表面会来平衡温度在很短的时间内如果湿表面附近的空气不断地通风干燥环境空气。湿布的平衡温度称为湿球温度。如果周围的空气完全饱和,以来就没有净冷却蒸发率就等于凝结在湿表面,离开湿球温度是一样的露点温度。不饱和空气湿球温度总是介于露点温度和干球温度(干球的区别和湿球温度的温度称为湿球温度的萧条)。注意,一个云滴蒸发或雨滴湿球温度的温度。
湿球温度可以用悬挂式湿度计测量,它包含一个温度计用湿纱布覆盖它的灯泡。这个手持设备在一短链保持接近新鲜空气在湿表面。没有摆动,停滞不前的饱和空气会积累在湿球和它的温度提高到一个错误的水平。水分子留下潮湿的表面扩散远离灯泡通过薄的边界层的空气围绕着它。同时从温暖的环境空气进行热量向冷湿表面通过相同的薄边界层。由于蒸发焓通量之间的平衡建立了由内分子和流入的焓变化。一个公式可以推导出给定的相对湿度,湿球温度和干球温度(见下面的盒子里湿球温度的推导)。在实际使用中表达的关系通常表。有趣的是,灯泡周围的湿布的几何配置并不重要,因为这些因素取消。更多的讨论湿球温度可以在练习中找到在第七章7.8和7.9。
饱和混合比率取决于温度和空气压力,因此它是一个高度的函数。包裹是解除绝热膨胀时,温度和压力降低。包裹是线性的和高度对温度的依赖关系(我们将在下一章是10 Kkm-1)。因此,上升1公里的空气温度将下降大约10 K。饱和蒸汽压变成一半的表面价值因此减少(还记得翻倍的经验法则的蒸汽压每10°C)。这个提升的混合比w0保持不变,而空气压力p (z)和蒸汽压e (z)包裹
温度
图5.10说明解除凝结水平(拼箱)。
温度
图5.10说明解除凝结水平(拼箱)。
每年秋季约12%(使用规模高度H(约8公里)的气氛:
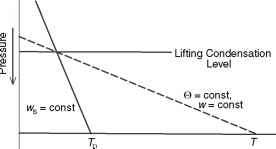
因此,蒸汽压下降12% ~而饱和蒸气压下降了50%。这表明饱和蒸气压下降速度远远超过实际的蒸汽压的包裹。随着这(相同的百分比为每公里提升)曲线将会发生交叉和冷凝。起初不饱和的包裹的水平达到饱和程度,提升绝热的叫做抬升凝结高度(拼箱)。如果我们知道温度,压力和混合比的空气包裹,我们可以找到拼箱,冷凝开始发生在提升。
如果我们知道混合比,我们可以很容易地找到露点和湿球温度,反之亦然。图5.10显示了一个包裹在初始温度T的拼箱,压力p,和露点道明。它位于直线的交点与常数潜在温度(不饱和包裹提升干绝热地)和饱和的等值线混合比从露点温度(这是因为混合比是固定在其初始值在此不能凝固的崛起的一部分)。这些参数的物理意义会更加清楚当我们开始工作与热力学图在第7章。
湿球温度的推导在前面我们的几何因素表明,取消在湿球温度的萧条。显示我们可以推出相对湿度之间的关系和湿球温度的萧条。为简单起见我们把灯泡的球体半径R0,但最终它并不重要几何e (z)
p (z) = p0e z / H ' w = w0 =常数,e
水分子
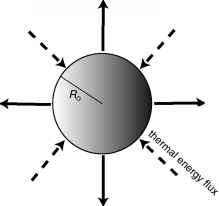
图5.11水蒸气分子扩散远离潮湿的表面进行热湿表面。当这些流量匹配,在湿表面温度将湿球温度。
水分子
图5.11水蒸气分子扩散远离潮湿的表面进行热湿表面。当这些流量匹配,在湿表面温度将湿球温度。
形状。有两个球体必须计算通量:(1)水蒸气分子的通量离开球由于蒸发对潮湿的空气远;(2)热进行的球体,因为温暖的空气远(图5.11)。
水蒸气分子扩散了通量弗兰克-威廉姆斯(r), r是球面的中心,距离r > R0。r的通量在任何价值通过周围的球体
在D是这个过程的扩散系数(表),nw (r)是蒸汽分子数密度的半径r。这种变化必须独立于r自否则会有流量的来源除了湿球的表面。我们可以设置弗兰克-威廉姆斯(r) = F0 =常数。这让我们从R0整合双方通过除以4 nr2d后x。这产生:
我们可以认识到,nR0 = nSat (Tw)
nsat (Tw) T = Tw的饱和数密度。如果我们通过除以nsat (Td)我们有nR0 fq
在RH = n«/ nsat (TD)是相对湿度湿球。到目前为止,我们不知道的价值F0在上面的公式。另一个测量是必需的。我们现在必须转向条件(2),热量传导。热量来自∞干湿球通过热传导。热通量的跨越半径的球面
H (r) = 4 n r2KH - = H0 =常数(5.48)
在kh博士(可以从表)导热系数和上面的相同参数用作恒常性的通量穿过不同半径的球体。
如上所述,我们可以整合后通过除以4 n r2KH的因素。我们得到:
4 n ROkH
还有另一个条件,热的通量与蒸汽分子的通量。每个分子的水蒸气离开到正无穷冷却的湿球我= L / Na L是水蒸气的蒸发焓每摩尔和Na是阿伏伽德罗常数。这个说
现在我们可以替代H0和将上述两个方程获得:„TT nsat (Tw) kH (TD - Tw)
我们使用干湿球湿度计测量TD和太瓦。我们可以计算nsat (TD)和nsat (Tw)克劳修斯——克拉珀龙方程关系。上面唯一未知是RH,现在可以计算。计算繁琐,因此,表。注意,几何因素4 nr0取消。它可以表明,无论网络的几何形状的灯泡,这些几何量将抵消和湿球温度灯泡的形状无关。为什么摆周围的干湿表?原因是有一两毫米内空气新鲜环境的干湿球以确保潮湿的空气在无穷远处代表而不是被污染的湿球的蒸发。
5.10平衡蒸汽压在一个曲面
到目前为止,我们的讨论的饱和蒸气压被限制在一个平面的水。然而,在大气物理学我们也遇到的情况表面是弯曲的。这种情况下,例如,在云液滴的形成。云滴近球形,这意味着液滴的增长意味着增加表面积的下降。增加液体的表面积需要工作(考虑吹肥皂泡)。增长的液滴然后需要考虑表面张力。从而找到平衡蒸汽压在滴我们必须包括在能量平衡表面张力。所需的能量增加了表面积dA dA,其中一个是表面张力(表面单位面积上的能量),在J m - 2(水是0.0761 J m - 2的值在0°C)。所需要的能量创造一个半径为a的球面drop4 a4na2。
考虑到云的形成液滴从纯粹的水蒸气(没有气溶胶或其他杂质存在)。这样一个过程叫做均匀成核与异相成核,当小气溶胶粒子参与液滴的形成。假设最初,在t = t1,我们有水蒸气分压的质量M e和温度t的吉布斯能量系统,Ginitial,
问在哪里具体(每单位质量)的吉布斯能量水蒸气。这取决于蒸汽压力和温度。假设在某个以后,t = t2,胚胎液滴开始形成。它生长在偶尔的坚持被水蒸气分子碰撞和有时发展半径和质量兆瓦。球形液滴的表面积是= 4 n a2。的总质量是守恒的,如果Mv是剩余水蒸气冷凝后的质量,
系统的总吉布斯能量在时间t2, Gfinal,
右边第一项(5.54)是吉布斯能量的水蒸气,第二种是液体的吉布斯能量,最后一项是由于表面张力。
吉布斯能量的变化可以发现由于液滴形成减去从(5.54)(5.52),考虑到(5.53):
Gfinal - Ginitial = (gw -全球之声)MW + a (5.55)
下一步是找到gw问的差异。我们知道在一个恒定的温度(在我们的例子中,温度是固定的)吉布斯能量的变化是dg = vdp,
4的例子一个肥皂泡是有益的。肥皂水的表面张力系数高于纯水表面张力是非常重要的。也必须记住,泡沫表面面积的两倍,因为有一个内表面和外表面,水滴形成鲜明对比。
蒸汽压e滴1蒸汽蒸汽压e

图5.13示意图说明符号的平衡蒸汽压滴,e,在一个平面上,es。
v是特定的体积(v =(密度)1)。然后,我们的蒸汽dgv = vv de,液体dgw =大众de,等于d的区别(全球之声- gw) =(大众)de«vv德(5.56)
因为vv»大众。用具体体积vv从理想气体定律,我们获得d(全球之声- gw) = RwT - = RwTd (ln e) (5.57)
后,e和一体化,全球之声- gw = RwT ln e +常数。(5.58)
我们可以发现积分常数的考虑,在平衡(见图5.13),在相界面,e = es (T)瓦=全球之声(见(5.7))。然后,全球之声- gw = RwT ln ^ e)。(5.59)
代入(5.59)(5.55)给出
Gfinal - Ginitial = -RwT ln (j - ^ Mw + OA。(5.60)
球形水滴的质量和半径和密度pw Mw = 3 npwa3,表面积是= 4钠。然后吉布斯能量的变化由于液滴的形成,AG) = Gfinai - Gjnitiai是:
AG) = 4 na3pwrwt ln (e | + 4 na2o。(5.61)
从(5.61)我们看到subsaturated空气,当e <, ln (e / es)是负的,和AG)总是正的(见图5.14)。从部分4.8.2我们知道平衡发生在吉布斯能量达到最小;或者,换句
/ e <西文 |
|
/ / / / / |
\ e >西文 |
一个* |
一个 |
图5.14吉布斯能量的变化由于水滴的形成液滴的半径的函数。
图5.14吉布斯能量的变化由于水滴的形成液滴的半径的函数。
单词,系统往往自发地对其平衡态通过吉布斯能量减少越来越多,直到到达最小。我们得出这样的结论:没有有利条件云滴(> 0)形成不饱和空气。
情况不同的过饱和空气时,这意味着e > es和ln (e / es)是积极的(见图5.14)。在这种情况下AG)增加随着半径的增加,然后达到一个最大半径,然后减少的进一步提高。如果云滴半径小于临界半径a *,它将通过蒸发消失。但是,如果云液滴达到临界半径,那么它将继续增长。我们能找到的临界半径的表达式将dG / da导数为零。结果是
被称为开尔文公式。它允许一个找到一个液滴半径的*在平衡与空气的蒸汽压e。这种平衡状态是不稳定的。这是明显的液滴的如果我们考虑一个轻微的增长。这种增长可能是因为附近的水蒸气的冷凝液滴,这意味着相对湿度降低表面上方。从附近的空气飞沫变得干燥,有潮湿的空气向滴的扩散通量,和凝结过程仍在继续,导致液滴的进一步增长。另一方面,如果液滴蒸发略,相对湿度增加,液滴表面上方的水蒸气开始分散液滴,液滴将继续保持相对湿度蒸发半径对应一个*。
我们可以把(5.62)为了确定平衡蒸汽压在液滴半径为a, e
Kpw Rw Ta在定义的参数b e = es exp (7 ^) = eseb / (5.63)
如果我们用一个= 0.076 Jm-2 pw = 1000公斤m3, Rw = 461.5 J公斤K-11,我们获得
(单位:米)。在273 K, b = 1.21 nm(通常是b ^)。公式(5.63)表明,平衡蒸汽压在一个球形液滴不等于饱和蒸气压的确定在一个平面的水。这是由于表面张力。如果液滴的半径趋于无穷,^ ro,对应于一个平面,我们得到结果平面e = es(见图5.13)。
示例5.8水滴的温度与周围的蒸汽平衡2°C。计算蒸汽压和相对湿度对液滴半径为0.008 m ^。
答:2°C的饱和蒸气压是:es = 2.497 x 109 exp (-5417/275.2) = 7.06 hPa (hPa)。从(5.63)得到e = 7.06 x exp (3.3 x 10 - 7 /结果(275.2 x 0.008 x 10 - 6)) = 8.2 hPa。RH = 116%。16%的过度饱和,需要建立一个云滴由均匀成核半径为0.008 m ^ 2°C。□
获取相对湿度,两边由es (5.63):
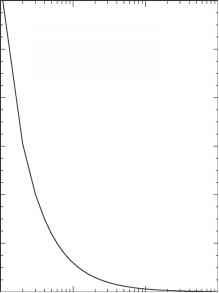
这种关系如图5.15所示的温度5°c .如图,形成液滴半径为0.01 m ^需要过度饱和的112%。与此同时,在现实云相对湿度很少超过101%。从图5.15中我们看到,1.0%需要过度饱和形成液滴半径大于0.1 m ^。大液滴在云不能形成的随机碰撞分子的表面。从上面的讨论,均匀成核的过程是不可能的。在自然界中云滴形成异相成核在大气气溶胶。考虑如何
0.10 - 1.00液滴半径,| m
图5.15的相对湿度作为液滴半径的函数。曲线绘制的温度5°C。这个图表显示了相对湿度必须形成一个液滴的大小在横坐标表示。
0.01
0.10 - 1.00液滴半径,| m
10.00
图5.15的相对湿度作为液滴半径的函数。曲线绘制的温度5°C。这个图表显示了相对湿度必须形成一个液滴的大小在横坐标表示。
平衡蒸汽压在液滴变化如果液滴包含电解质溶解(通常从气溶胶,如海盐)。我们将考虑吸湿颗粒(那些溶于水)。最常见的氯化钠(氯化钠)和硫酸铵((NH4) 2 so4)溶解在水凝结而成的。在这种情况下,水滴可以被视为一个解决方案和水作为溶剂和溶质盐。
化学复习:拉乌尔定律的比例平衡蒸汽压在一个解决方案,e“,在纯溶剂平衡蒸汽压,e,等于溶液中溶剂的摩尔分数,f, e”/ e = f。在溶液中盐的存在总是降低蒸汽压。
考虑一个包含nsalt分子云滴的盐和nw分子单位体积的水。如果e是平衡蒸汽压解决方案(见图5.16),那么,根据拉乌尔定律,e e
5.10平衡蒸汽压在一个曲面蒸汽压e的蒸汽压e蒸汽蒸汽

图5.16说明的符号。左:饱和蒸汽压e”滴在一个解决方案。中心:饱和蒸汽压e在纯粹的水滴。右:饱和蒸汽压在一个平面上。
其中e是纯溶剂组成的平衡蒸汽在滴。第二个表达式之前,分子和分母除以西北。如果我们考虑到稀溶液nsait ^ nw,扩大分母在几何级数(5.67),我们发现(只保留线性项),e - 1 _“盐
在(5.68)离子的离解效应尚未考虑。如果盐的解离为离子,说Na +和Cl -给我= 2,溶质的摩尔数个人滴,vsalt,
米盐Msalt
Msait和Msalt盐的质量和分子量分别在这里(一定要使用公斤每摩尔分子量)。离子离解的程度我~ 3 ~ 2氯化钠和硫酸铵。水的摩尔数与分子量质量兆瓦兆瓦
兆瓦兆瓦,液滴的半径。6摩尔数之比等于数量密度的比值:
nsalt Vsalt 3 i ^ saltMw
后替换(5.71)(5.68)得到
5 = 1的几何级数_ e + e2 _•••, | | e < 1。
6我们假设溶解盐粒子不会改变液滴的体积。
我们引入一个新的参数简化符号c = 3 imsaltmw / 4 ^ pwMSalt。(5.73)
后用pw = 1000公斤m3, Mw = 18 gmol-1我们获得c«4.3 x 10-6i ^ ^ (m3)。(5.74)
结合开尔文公式(5.66)和(5.72),我们得到的公式解决方案的平衡蒸汽压滴:
为了更好的理解这个公式考虑极限情况。我们再次让液滴半径的走到正无穷,^ ro。从< 5.75)得到的已知结果:平面的平衡蒸汽压水< = ro)等于饱和蒸气压,e ' =。
现在考虑一个液滴半径»b。然后可以扩大在< 5.75)指数函数泰勒级数7和得到的
右边第二项的< 5.76)负责表面张力,第三项是由于液滴的盐的存在。图形的说明图5.17中给出了公式< 5.76)10 - 19公斤的氯化钠。曲线显示的依赖相对湿度在溶液液滴半径曲线称为科勒。虚曲线对应于均匀成核< 5.63)没有盐。这两条曲线相当小的值不同的半径解决方案滴。最重要的结果是,与嵌入式可溶性盐核滴要求更低的过度饱和的液滴在平衡环境中比在纯相同大小的水滴。例如,过度饱和的只有0.1%的液滴半径略大于0.1 ^米可以形成。与一个非常小的液滴半径可以在平衡与周围的空气相对湿度小于100%。这是可能只是因为吸湿颗粒的存在。相对湿度90%溶液液滴半径为0.05 m ^可以形成如果有10 - 19公斤的氯化钠<图中没有显示)。
液滴半径小,科勒曲线单调增加,直到达到最大半径=“,然后减少单调。考虑e
ffi oc
99年0.01
\ |
exp (b / a) |
\ |
|
\ |
|
\ |
|
\ |
|
/ ^ ^ ^ |
|
0.10 - 1.00液滴半径,| m
图5.17相对湿度与溶液液滴形成10 - 19公斤的氯化钠与水蒸气平衡液滴半径的函数。温度是5°C。
0.10 - 1.00液滴半径,| m
10.00
图5.17相对湿度与溶液液滴形成10 - 19公斤的氯化钠与水蒸气平衡液滴半径的函数。温度是5°C。
一个液滴半径不到”。如果相对湿度增加,这种粒子生长适应新的平衡条件。平衡是稳定的,因为轻微的蒸发冷凝波动或不导致液滴的进一步增加或减少。如果由冷凝液滴生长略,相对湿度的增加,扩散通量是远离液滴,液滴蒸发回到平衡状态。附近有轻微的蒸发,相对湿度减少,导致扩散通量向液滴,液滴再次回到平衡与周围的空气。这样的液滴半径小于“被称为烟雾粒子。
情况是不同的,如果液滴半径达到”。现在的平衡是不稳定的。与任何进一步增长的液滴相对湿度降低和液滴还在继续增长。这是一个云滴形成的机制。
示例5.9盐粒子有多大的质量是10 - 19公斤吗?使用2165公斤m3的密度,我们可以计算出一个球形粒子的质量会有一个半径为0.022 m ^。这有多少分子粒子吗?摩尔数M / MNaCl = 10-19x 1000/58.44kgmol-1 = 0.017 x10-16mol。分子的数目是阿伏伽德罗常数乘以摩尔数:1.03 x106分子。□
5.11等压混合的空气包裹
当两个包裹同时干燥的空气压力(高度)和混合接触,那么最终的温度
M1T1 + M2T2
如果包裹w1和w2的混合比例,我们可以到达相同的线性关系
M1w1 + M2w2
虽然可能组合(w1, T1)和(w2, T2)既不是一个单独饱和,混合的空气包裹(wf Tf)饱和。两个明显的潮湿的空气包裹可以接触到一个雾蒙蒙的结果。
示例5.10假设两个包裹的数量和压力,但不同温度(273 K和293 K)接触地面附近(p = 1000 hPa)。让每一个相对湿度90%。我们可以使用p = V V RT2 RT1也=。(5.79)
然后
最后一个温度:
继续阅读:WsTd w
这篇文章有用吗?
读者的问题
-
sesuna3个月前
- 回复