系统与平衡
热力学是研究宏观或体积系统的质量和他们的相互关系的条件下的稳定状态(不依赖于时间)。通过宏观,我们指的是系统包含大量的单个分子(在一个摩尔的几个数量级内,包含6.02 x 1023个分子)。我们称这些态为平衡态,如果它们不仅与时间无关,而且在小扰动下是稳定的。热力学状态可以用一组维量来描述,我们称之为坐标。热力学研究的是当系统从一种状态转变到另一种状态时,与能量相关的量(某些坐标)的变化。热力学系统是一个空间区域,其中含有具有某些内部均匀性质的物质,如压力和温度。我们将关注系统的内部和表征它的变量(坐标)。例如,容器中含有的大量纯气体(只有一种化学物质)可以用它施加在容器壁上的压力、容器体积和温度(p, V, T)来表征。这些构成了这个特定系统的一整套热力学坐标。对于更一般的情况,例如物种或相的混合,描述状态所需的坐标必须通过实验确定。重要的是要注意,一个独立的热力学系统在其内部是均匀的。 There are no gradients of pressure or temperature, for example, inside the system.2
摩尔是国际单制单位,定义为质量为0.012千克的纯碳中碳原子的数量。物质的摩尔数是这个数的倍数(称为阿伏伽德罗数:Na = 6.02 x 1023)。在公式中,单位被指定为“mol”。
2请注意,大气中的气柱不是一个简单的热力学系统,因为它的压力和温度随高度而变化。但是,可以方便地将柱视为由薄板组成,每一块薄板包含的物质具有近似均匀的温度、压力和成分。那么每一个单独的平板都可以被认为是一个简单的热力学系统。
1.3.1热力学系统的例子
假设一个容器中装有化学成分均匀的气体。容器的壁要隔热,体积要固定。在固定这些条件后,在很短的时间内,气体的温度值和压力将是均匀的,并且与容器的形状无关。这是平衡状态下最简单的热力学系统。
第二种情况是容器壁保持在一个固定的温度下,允许压力变化。平衡将被建立,使得气体的温度与周围壁面的温度相等,体积是给定的,压力达到我们可以估计的某个值。
第三种情况是容器有一个无摩擦的可移动活塞,由固定压力(如大气压力)在外部推动。这意味着容器内的压力与温度的压力是固定的。活塞会以这样的方式移动,使内部的压力与外部的压力相等,并且体积会改变,直到所有这些条件都满足。
我们的气体可能不是均匀的,相反,它可能是由化学上不相互作用的气体组成的混合物,比如我们大气中的气体:氮、氧和氩。我们仍然有一个热力学系统只要组分不随位置或时间的变化而变化。在上述每种情况下,请确定以下两项:体积、温度或压力。然后让剩下的变量找到它的均衡值。注意,一旦处于平衡状态,变量或坐标在整个容器中是均匀的。
假设我们有一种化学成分均匀的液体,比如容器里有水,而液体表面是真空。温度和体积是固定的。经过足够的调节时间后,一些液体将蒸发到其表面以上的体积中,并建立平衡(离开表面的水分子通量与进入并粘附在表面的水分子通量相等)。从液体表面蒸发出来的蒸汽会对壁面施加气体压力。这是一个有液相和气相的两相系统,但只有一种成分(水)描述了不同化学物种的数量。整个过程的压力将是均匀的(忽略由于液体重力引起的压力增加作为深度的函数)。在整个系统的两个阶段,温度也将是均匀的。这个两相结构也是一个热力学系统。可以使系统通过体积、温度等的变化来建立新的平衡热力学状态。注意,温度和压力是均匀的,但密度从一个相到另一个。 As we shall see in a later chapter there is another quantity that is also uniform in the two-phase system called the specific Gibbs energy (chemical potential in the chemical literature when expressed as molar Gibbs energy). It acts as an intensive variable (see Section 1.5) in such multicomponent systems similarly to pressure or temperature.
想象一个装满水的容器(在固定的温度和压力下),液体中放入一些盐。如果我们继续往水里放更多的盐,最终会有一些盐留在水中晶体形式下沉到底部(否则忽略重力)。我们将在饱和的盐溶液和析出的结晶盐之间建立一种平衡。温度的变化会导致溶液中盐浓度不同的新的平衡状态(溶液中盐的浓度是另一个热力学坐标)。这是一个热力学系统的例子。这种变化包括允许液体上方的水蒸气与盐水溶液保持平衡。溶液中盐的存在会改变液体表面的蒸汽压(以及冻结温度)。随着温度的变化,蒸汽压也会发生变化,等等。
想象一下,在固定的温度和压力下,容器中有一种由O和O2组成的气体混合物。将会有一个反应,其中M是一个背景分子,用来带走动量(例如,大气中的O2, N2或Ar)一些臭氧会衰变,过一段时间就会建立一个平衡,反应可以写成:
在给定温度下,反应物的量(左边)可能大于生成物的量(右边)。但随着温度的变化,平衡可能会发生变化。这是一个热力学系统。O2和O3的比值现在是热力学坐标,和T p V Mtotal一样。
当然,还有许多其他类型的热力学系统,我们将在适当的时候遇到其中的几个。
系统外部任何可能影响系统行为的东西都被称为环境。在大气科学中,我们通常可以将嵌入在自然大气中的无限小体积的气体近似为具有均匀的内部特性。在适当的时候,这种无限小的体积元可以看作是一个热力学系统。在许多情况下,“无穷小体积元件”可能像一个教室那么大,有时也可能小到一立方厘米,这取决于应用程序。
一个由一个非常大的质量组成的热力学系统被称为热源,其特征是一个温度,TR。如果一个有限系统通过一个热膜(允许通过的膜)与热源接触
3能量和动量不能同时守恒,当两个物体向一个物体释放能量时。
碰撞中的第三个物体可以提供保护两者的方法。
p (hPa) 1000
1kg空气的等温线
1kg空气p(hPa) 1000的等温线
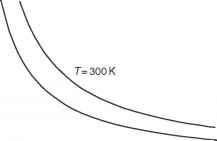
图1.1以1kg干空气为理想气体的等温线纵坐标为压强,单位为hPa,横坐标为体积,单位为m3。上曲线,300k;下曲线,200k。
图1.1以1kg干空气为理想气体的等温线纵坐标为压强,单位为hPa,横坐标为体积,单位为m3。上曲线,300k;下曲线,200k。
热能,4,而不是质量),较小的系统将调整其坐标值(对于气体,p, V, T)到新的值,而储层不会明显改变其状态(这实际上定义了储层的质量)。系统与储层达到热平衡(它的温度接近储层的温度)。在气态系统的情况下,实验表明,在给定的储层中,系统处于平衡状态的值对(V, p)的轨迹-换句话说,在V-p平面上有一条曲线p = pT (V)。换句话说,如果我们的系统有一个固定的体积,那么当它与温度为T的热源接触时,压强总是相同的值,p = pT(V)。当我们用不同的控制体积做实验时,我们可以在V-p平面上扫出点的轨迹。这条曲线称为该储层温度的系统等温线(图1.1)。等温线表示当系统与固定温度的储层接触时可能发生的一系列平衡状态。例如,体积可能会因壁尺寸的改变而被迫改变(例如,活塞可以在包含所讨论系统的气缸中具有不同的位置)。在这种情况下,压强会随着等温线上体积的变化而变化。我们可以发明一种算法基于一系列的不同的温度要建立一个温标,对于我们目前的目的来说,只需使用我们熟悉的温度计就足够了。
热能是指系统中分子的微观运动。当处于绝热接触时,来自一个系统的分子的热能可以通过碰撞从该系统传递到它的相邻系统。两个系统的热能最终会相等。在后面的章节中会有更多的内容。热能的传递被松散地称为热传递。
1000

图1.2以1kg干空气为理想气体的等温线和绝热线。上面的曲线(实线)是300k等温线,虚线是在V = 1m3时通过300k等温线的绝热曲线。纵坐标为压强,单位为hPa,横坐标为体积,单位为m3。
图1.2以1kg干空气为理想气体的等温线和绝热线。上面的曲线(实线)是300k等温线,虚线是在V = 1m3时通过300k等温线的绝热曲线。纵坐标为压强,单位为hPa,横坐标为体积,单位为m3。
当系统与其他系统隔离(没有质量或热能流入或流出系统)时,系统也可以处于平衡状态。我们称之为孤立系统。它可以有坐标就像系统与热源接触的情况一样。我们称孤立系统中不同体积的压力轨迹为绝热(图1.2)。我们可以通过使孤立系统接触不同的热源,直到找到一个不改变系统坐标的热源,来求得孤立系统在固定的p和V值下的温度。系统和热源的温度是一样的。用这种方法,我们可以绘制出定义等温线的点的轨迹,该等温线穿过绝热点。作为一个更简单的选择,我们可以插入一个温度计,它的质量非常小,它将与系统达到平衡(对于微小的温度计来说,系统现在是一个蓄水池),而不会明显地干扰系统的状态。
热力学平衡状态不需要时间。它们是稳定的,只需要了解热力学坐标,如温度,压力和体积。当系统所经过的“状态”涉及到时间时,我们不能用热力学平衡态来描述它们。传统热力学不能用来描述在非平衡状态下发生的事情。
一个系统的某些变化可以通过一系列无限小的接近平衡状态而发生。例如,我们可以一次让系统与一系列温度相差无限小的热源接触,在每一步我们都等待平衡的建立。我们称之为准静态过程。这种准静态过程可以在实验室中近似计算。从分子的角度来看,系统内部的气体在限制条件的每一个无穷小的移动中都必须有时间来调整到与周围环境的新平衡状态。在气体中,这大约是一个典型分子进行几百次碰撞的时间,但对于有限大小的体积,使用声波在该体积中穿行几百次的时间可能更合适。这种多次遍历时间适用于压力,但其他属性可能需要相当长的时间。例如,温度和物质浓度平滑的速度要慢得多,因为这些差异是通过热传导等扩散过程平滑的。由于湍流引起的搅拌可以加速均质化,但即使这样,调整速度也比压力差要慢。在沿着这样的系统路径的每一个无限小的步骤(等待这些调整)中,我们可以反转方向并回溯相同的步骤。 This is a reversible process.
请注意,一个系统可以从一个热力学状态到另一个热力学状态的路径,不涉及这样的热力学状态序列。我们称之为不可逆的状态变化。一个例子不可逆过程是系统自发地从状态a到状态B,而不是从状态B到状态a的情况,一个具体的例子是,如果两块砖,一块热的,一块冷的,接触,结果是两块热的砖。这是一个不可逆的过程。请注意,当我们让两块热砖接触时,我们不会得到一块热砖和一块冷砖(即使能量是守恒的)。
可逆过程实际上并不存在于自然界中。那么为什么要研究它们呢?原因很简单。首先,不可逆过程几乎不可能从理论上进行处理。其次,经验表明,在许多情况下,当我们把自然界中确实发生的近似准静态过程视为完全准静态时,近似这些过程的效果相当好。然后,我们继续采用从业人员多年来使用的哲学:我们将通过理想化的可逆类比自由地近似真实环境中的许多过程,以便获得可用于实际情况的数值结果。
继续阅读:理想气体基础知识
这篇文章有用吗?
读者的问题
-
Ranugad19天前
- 回复
-
riitta19天前
- 回复
-
马里亚姆19天前
- 回复
-
mewael1个月前
- 回复
-
拉维妮娅2个月前
- 回复
-
汉斯·kaitainen2个月前
- 回复
-
凯文daecher2个月前
- 回复
-
》2个月前
- 回复
-
卡罗拉2个月前
- 回复
-
NEBYAT SAARE3个月前
- 回复