范德华方程
正如我们之前学过的,如果我们可以忽略分子间作用力,理想气体的近似可以很好地工作。对于专业来说,这几乎总是如此空气的成分在类似地球的条件下。但是当气体接近临界温度时,液体或固体状态可以与气相共存,偏离理想状态是很重要的。如图5.2所示,理想气体的状态方程描述了真实气体在高温和低压的极限情况下。理想气体的等温线是矩形双曲线(p a 1 /V)。小的压力下降导致体积大的增加(图5.2中的B到A)。但是,当气体的温度低于临界点,体积处于等温线变水平的范围内(见图5.2中C到B的平坦段),理想气体的状态方程就不再是一个很好的近似;也就是说,有一种液体和气体的混合物处于平衡状态。
范德华斯推导出了一个非常有用的方程,描述了许多物质在很宽的温度和压力范围内的行为。1mol气体的范德瓦尔斯方程是:
[范德瓦尔斯方程](5.2)
其中a和b是常数(不同物质不同),v是每摩尔气体的体积(即减少体积或比体积)。(5.2)中的项b是由于分子的有限大小,而项a/v2是由于分子吸引力的作用。当a = b = 0时,范德瓦尔斯方程简化为理想气体定律(5.2)。
通常范德华方程是这样写的
图5.4显示了用范德华方程计算等温线的例子。如果我们比较图5.2和5.4,我们可以看到范德华斯等温线
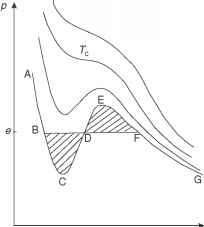
图5.4范德华等温线。有拐点的等温线是临界等温线。平衡蒸气压e使阴影面积相等。
图5.4范德华等温线。有拐点的等温线是临界等温线。平衡蒸气压e使阴影面积相等。
再现真实气体行为的许多特征。如图5.4所示,在大v和低p时,体积有较大的增加,而压力有较小的下降。对于液体(小v和高p),体积有一个小的减少,压力有一个大的增加。存在一个温度T = Tc的临界等温线,表示一个拐点(d2p/dv2 = 0),温度高于Tc的等温线与图5.2中的等温线非常相似。然而,温度小于Tc的等温线看起来很不一样:在水和蒸汽两相共存的区域,它们不是水平的。考虑一个特殊的等温线ABCDEFG从范德华方程导出。让我们压缩气体,直到在等温线上的F点达到饱和。然后随着体积的进一步减小,压力没有增加,这对应于水平拉伸FB。相反,范德华等温线显示了压力的增加(图的一部分FE)。沿着曲线的这个分支,蒸汽是过饱和的。 Vapor can theoretically exist for these values, but if a small impurity is present such as a dust particle, or a scratch on the wall, the vapor will begin to condense on this site and the system will collapse to the flat horizontal line BF in Figure 5.4. In other words this state of the vapor is unstable: any disturbance causes it to migrate to a stable condition which contains two subsystems, vapor and liquid. So, if we plot the van der Waals isotherm for a given temperature, we will not find the flat portion (BDF) which we know should be there (from experiment). We have to put it in "by hand." But how do we decide the proper pressure value at which to insert this flat portion? The rule (first discovered by Maxwell) is that the areas bounded by the curves BCDB and DEFD have to be equal. Let us sketch a proof. Consider the cycle FEDCBDF in Figure 5.4
(侧面有一个“8”字)。根据热力学第一定律,我们知道,对于一个等温过程,在一个封闭循环过程中所做的功等于系统吸收的热量,AW = AQ,因为循环过程的热力学能的变化为零。我们还知道循环积分dQrev/T = 0(我们的过程是可逆的)。对于等温过程,我们可以把温度从积分中提出来,得到Qloop = 0。由于Qloop = 0,我们也有Wloop = 0。如果水平线的面积不相等,我们想象的(但可实现的)过程将违反热力学定律(dU = 0或±dS = 0或两者都是)。
关于不稳定状态(过饱和等)的优秀讨论可以在高级书籍中找到,特别是Callen(1985)的讨论,其中的情况是用范德华体系来说明的稳定性判据可以用热力学函数的凹面或凸面来表示:
d 2 s |
d 2 s |
|||
d U 2 |
> 0, |
d V2 > 0 |
(稳定性判据) |
|
或者吉布斯能: |
||||
d 2 g |
d 2 g |
|||
d T 2 |
< 0, |
dG < 0 |
稳定性判据。 |
|
如果S (U, V, M)和G(T, p, M)的图形具有错误的凹面符号,则准则失效的曲线分支将不稳定。
继续阅读:信息Ixl
这篇文章有用吗?
读者的问题
-
Tranquillino2个月前
- 回复
-
马塞洛2个月前
- 回复
-
路易莎Monaldo2个月前
- 回复
-
蒂姆2个月前
- 回复